Model Atom Bohr

- 2732
- 693
- Joseph Nader PhD
Dia Model Atom Bohr Ini adalah konsepsi fisikawan Denmark Niels Bohr (1885-1962) tentang struktur atom, yang diterbitkan pada tahun 1913. Dalam atom bohr, elektron di sekitar nukleus hanya menempati orbit tertentu yang diizinkan, berkat pembatasan yang disebut kuantisasi.
Untuk Bohr, gambar atom sebagai tata surya miniatur, dengan elektron dengan mengorbit di sekitar nukleus, itu tidak sepenuhnya konsisten dengan fakta bahwa muatan listrik, ketika mereka dipercepat, memancarkan energi.

Atom seperti itu tidak akan stabil, karena akan berakhir untuk runtuh cepat atau lambat karena elektron akan mengendap secara spiral ke nukleus. Dan pada saat itu, 50 tahun yang lalu pola cahaya karakteristik yang memancarkan hidrogen dan gas lainnya saat memanaskan.
Pola atau spektrum terdiri dari serangkaian garis terang dari panjang gelombang tertentu yang sangat spesifik. Dan atom hidrogen tidak runtuh dengan memancarkan cahaya.
Untuk menjelaskan mengapa atom stabil meskipun mampu memancarkan energi elektromagnetik, Bohr mengusulkan bahwa momentum sudut hanya dapat mengadopsi nilai -nilai tertentu, dan oleh karena itu energi juga. Inilah yang dipahami dengan kuantisasi.
Menerima bahwa energi dikuantisasi, elektron akan memiliki stabilitas yang diperlukan untuk tidak terburu -buru ke arah nukleus yang menghancurkan atom.
Dan atom hanya memancarkan energi cahaya ketika elektron melakukan transisi dari satu orbit ke orbit lainnya, selalu dalam jumlah diskrit. Dengan cara ini keberadaan pola emisi dalam hidrogen dijelaskan.
Bohr yang disusun dengan cara ini sebuah visi atom yang mengintegrasikan konsep -konsep yang diketahui dari mekanika klasik dengan yang baru ditemukan, seperti konstanta Planck, foton, elektron, inti atom (Rutherford telah menjadi mentor Bohr) dan spektrum yang disebutkan di atas masalah yang disebutkan di atas,.
[TOC]
Karakteristik utama model Bohr
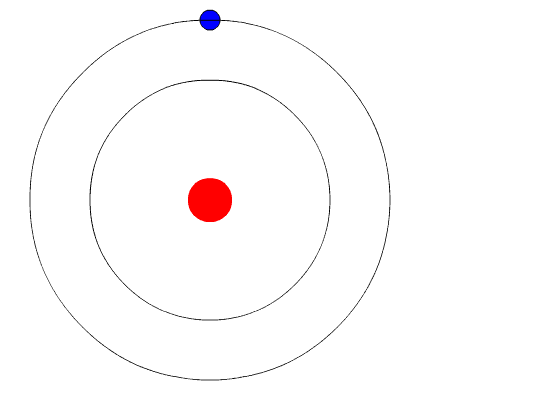 Atom Bohr. Animasi mewakili elektron saat beralih dari tingkat energi yang lebih tinggi ke energi lain yang lebih sedikit, memancarkan cahaya cahaya (foton). Sumber: Wikimedia Commons.
Atom Bohr. Animasi mewakili elektron saat beralih dari tingkat energi yang lebih tinggi ke energi lain yang lebih sedikit, memancarkan cahaya cahaya (foton). Sumber: Wikimedia Commons. Model atom Bohr mengasumsikan bahwa elektron bergerak dalam orbit melingkar di sekitar inti dengan aksi tarik elektrostatik Coulomb dan mengusulkan bahwa momentum sudut elektron dikuantisasi.
Dapat melayani Anda: menyeimbangkan vektor: perhitungan, contoh, latihanMari kita lihat bagaimana mengintegrasikan kedua konsep dalam bentuk matematika:
Biarkan L besarnya momentum sudut, m massa elektron, dan kecepatan elektron dan r jari -jari orbit. Untuk menghitung l yang kita miliki:
L = m⋅r⋅v
Bohr mengusulkan bahwa L sama dengan seluruh kelipatan h/2π konstan, di mana h adalah Konstanta Planck, Diperkenalkan beberapa waktu yang lalu oleh fisikawan Max Planck (1858-1947) dalam memecahkan masalah energi yang dipancarkan oleh tubuh hitam, objek teoretis yang menyerap semua cahaya kejadian.
Nilainya h = 6.626 × 10−34 J ・ s, sedangkan pada h/2π itu dilambangkan sebagai H, Itu berbunyi "H bar".
Karena itu, momentum sudut tetap:
m⋅r⋅v = nH, Dengan n = 1.2, 3 ..
Dan dari kondisi ini radio orbit yang diizinkan untuk elektron disimpulkan, seperti yang akan kita lihat saat itu.
Perhitungan radius orbit elektron
Berikut ini kita akan mengasumsikan atom yang paling sederhana: hidrogen, yang terdiri dari proton tunggal dan elektron, baik dengan beban besar dan.
Gaya sentripetal yang menjaga elektron di orbit melingkar disediakan oleh objek wisata elektrostatik, yang besarnya F adalah:
F = ke2/R2
Di mana k adalah konstanta elektrostatik dari coulomb dan r law jarak elektron-protein. Mengetahui bahwa dalam gerakan melingkar percepatan sentripetalC Itu diberikan dengan alasan antara kuadrat kecepatan dan jarak r:
keC = v2 / R
Oleh hukum kedua Newton, Net Force adalah produk massa M dengan akselerasi:
MV2/r = ke2/R2
Menyederhanakan Radio R diperoleh:
M⋅v2R = ke2
Menggabungkan ekspresi ini dengan momentum sudut kita memiliki sistem persamaan, yang diberikan oleh:
Itu dapat melayani Anda: lintasan fisik: karakteristik, jenis, contoh dan latihan1) MV2R = ke2
2) r = n H/mv
Idenya adalah untuk menyelesaikan sistem dan menentukan r, jari -jari orbit yang diizinkan. Aljabar dasar kecil mengarah pada jawabannya:
R = (nH)2 / K⋅m⋅e2
Dengan n = 1, 2, 3, 4, 5 ..
Untuk n = 1 kita memiliki paling sedikit radio, disebut Radio Bohr asalah satu Dengan nilai 0,529 × 10−10 M. Radio orbit lain dinyatakan dalam hal kesalah satu.
Dengan cara ini Bohr memperkenalkan angka kuantum utama N, menunjukkan bahwa radio yang diizinkan didasarkan pada konstanta Planck, konstanta elektrostatik dan massa dan beban elektron.
Model atom bohr mendalilkan
 Fisikawan Denmark Niels Bohr (1885-1962).
Fisikawan Denmark Niels Bohr (1885-1962). Bohr dengan terampil menggabungkan mekanika Newton dengan penemuan baru yang terus memberikan selama paruh kedua abad ke -19 dan awal abad ke -20. Di antara mereka konsep revolusioner "berapa banyak", yang Planck sendiri mengklaim tidak terlalu yakin.
Melalui teorinya, Bohr dapat dengan memuaskan menjelaskan serangkaian spektrum hidrogen dan memprediksi emisi energi di peringkat ultraviolet dan inframerah, yang belum diamati.
Kami dapat meringkas postulat Anda sebagai berikut:
Elektron menggambarkan lintasan melingkar
Elektron berputar di sekitar nukleus dalam orbit melingkar yang stabil, dengan gerakan melingkar yang seragam. Gerakan ini disebabkan oleh daya tarik elektrostatik yang diberikan nukleus di atasnya.
Momentum sudut dihitung
Momentum sudut elektron dikuantisasi sesuai dengan ekspresi:
L = mvr = nH
Di mana n adalah bilangan bulat: n = 1, 2, 3, 4 ..., yang mengarah ke elektron hanya dapat dalam orbit tertentu yang ditentukan, yang radionya adalah:
R = (n H)2 / k m e2
Elektron memancarkan atau menyerap foton ketika mereka berpindah dari satu keadaan energi ke negara lain
 Saat bergerak dari satu keadaan energi ke negara lain, elektron menyerap atau memancarkan energi dalam jumlah diskrit yang disebut foton. Sumber: Wikimedia Commons.
Saat bergerak dari satu keadaan energi ke negara lain, elektron menyerap atau memancarkan energi dalam jumlah diskrit yang disebut foton. Sumber: Wikimedia Commons. Karena momentum sudut dikuanisasi, energi dan juga. Dapat ditunjukkan bahwa E diberikan oleh:
Dapat melayani Anda: bidikan vertikal: formula, persamaan, contoh
Volt Electron atau EV, adalah unit lain untuk energi, banyak digunakan dalam fisika atom. ENERGI PENGATURAN NEGATIF PERTAMAKAN STRIBILY ORBIT, menunjukkan bahwa pekerjaan harus dilakukan untuk memisahkan elektron dari posisi ini.
Saat elektron berada di orbitnya tidak menyerap atau memancarkan cahaya. Tetapi ketika melompat dari orbit energi yang lebih besar ke yang lebih rendah.
Frekuensi F dari cahaya yang dipancarkan tergantung pada perbedaan antara tingkat energi orbit:
E = HF = Eawal - eterakhir
Batasan
Model Bohr memiliki keterbatasan tertentu:
-Itu hanya berhasil berlaku untuk atom hidrogen. Mencoba menerapkannya pada atom yang lebih kompleks tidak berhasil.
-Tidak menanggapi mengapa beberapa orbit stabil dan yang lain tidak. Fakta bahwa energi dalam atom dikuantisasi bekerja dengan sangat baik, tetapi model itu tidak memberikan alasan, dan itu adalah sesuatu yang menyebabkan ketidaknyamanan bagi para ilmuwan.
-Keterbatasan penting lainnya adalah tidak menjelaskan garis tambahan yang dikeluarkan oleh atom di hadapan medan elektromagnetik (efek Zeeman dan efek mencolok). Atau mengapa beberapa garis spektrum lebih intens daripada yang lain.
-Model Bohr tidak mempertimbangkan efek relativistik, yang diperlukan.
-Dibutuhkan begitu saja bahwa adalah mungkin untuk mengetahui secara tepat posisi dan kecepatan elektron, tetapi yang benar -benar dihitung adalah probabilitas bahwa elektron menempati posisi tertentu.
Terlepas dari keterbatasannya, model ini sukses besar pada saat itu, tidak hanya untuk mengintegrasikan penemuan baru dengan elemen yang sudah diketahui, tetapi karena itu menunjukkan pertanyaan baru, membuatnya jelas bahwa jalan menuju penjelasan yang memuaskan dari atom adalah dalam mekanika kuantum.
Artikel yang menarik
Model Atom Schrödinger.
Model Atom Broglie.
Model Atom Chadwick.
Model Atom Heisenberg.
Model Atom Perrin.
Model Atom Thomson.
Model Atom Dalton.
Dirac Jordan Atomic Model.
Model Atom Demokritus.
Model Atom Leucipo.
Model Atom Sommerfeld.
Model atom saat ini.


