Model Atom Schrödinger

- 708
- 11
- Leland Robel
Apa model atom Schrödinger?
Dia Model Atom Schrödinger Ini adalah proposal untuk operasi dan struktur atom yang dikembangkan oleh Erwin Schrödinger pada tahun 1926. Ini dikenal sebagai model mekanik kuantum atom, dan menggambarkan perilaku gelombang elektron.
Untuk ini, fisikawan Austria yang luar biasa didasarkan pada hipotesis Broglie, yang menyatakan bahwa setiap partikel bergerak dikaitkan dengan gelombang dan dapat berperilaku seperti itu.
 Erwin Schrödinger
Erwin Schrödinger Schrödinger menyarankan bahwa pergerakan elektron dalam atom sesuai dengan dualitas gelombang-partikel, dan akibatnya, elektron dapat memobilisasi di sekitar nukleus sebagai gelombang stasioner.
Schrödinger, yang dianugerahi Hadiah Nobel pada tahun 1933 atas kontribusinya pada teori atom, mengembangkan persamaan homonim untuk menghitung probabilitas bahwa elektron akan berada dalam posisi tertentu.
Karakteristik Model Atom Schrödinger
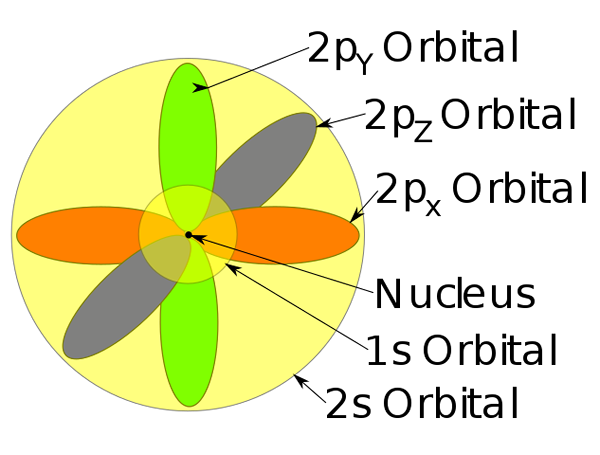 Orbital 1s, 2s dan 2p di dalam atom natrium.
Orbital 1s, 2s dan 2p di dalam atom natrium. -Model atom ini menggambarkan pergerakan elektron sebagai gelombang stasioner.
-Elektron bergerak terus -menerus, yaitu, mereka tidak memiliki posisi tetap atau ditentukan dalam atom.
-Model ini tidak memprediksi lokasi elektron, juga tidak menggambarkan rute yang dibuat di dalam atom. Hanya menetapkan zona probabilitas untuk menemukan elektron.
-Area probabilitas ini disebut orbital atom. Orbital menggambarkan gerakan terjemahan di sekitar inti atom.
-Orbital atom ini memiliki tingkat tingkat yang berbeda dan sub -level, dan dapat didefinisikan antara awan elektron.
-Model ini tidak merenungkan stabilitas nukleus, itu hanya mengacu pada menjelaskan mekanika kuantum yang terkait dengan pergerakan elektron dalam atom.
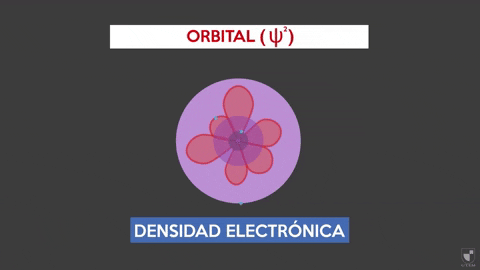 Kepadatan elektronik menunjukkan probabilitas menemukan elektron di dekat nukleus. Semakin dekat nukleus (zona ungu) akan ada lebih banyak kemungkinan, sementara itu akan lebih sedikit jika Anda pindah dari nukleus (area violet).
Kepadatan elektronik menunjukkan probabilitas menemukan elektron di dekat nukleus. Semakin dekat nukleus (zona ungu) akan ada lebih banyak kemungkinan, sementara itu akan lebih sedikit jika Anda pindah dari nukleus (area violet). Percobaan
Model atom Schrödinger didasarkan pada hipotesis Broglie, serta model atom Bohr dan Sommerfeld sebelumnya.
Dapat melayani Anda: gesekan dinamis atau kinetik: koefisien, contoh, latihanBroglie mengusulkan bahwa sama seperti gelombang memiliki partikel, partikel memiliki sifat gelombang, memiliki panjang gelombang terkait. Sesuatu yang menghasilkan banyak harapan pada saat itu, menjadi Albert Einstein pada teorinya.
Namun, teori Broglie memiliki kekurangan, yaitu makna ide sendiri tidak dipahami dengan baik: elektron bisa menjadi gelombang, tetapi bagaimana dengan apa? Saat itulah sosok Schrödinger tampaknya menjawab.
Untuk melakukan ini, fisikawan Austria mengandalkan percobaan Young, dan berdasarkan pengamatannya sendiri, ia mengembangkan ekspresi matematika yang menyandang namanya.
Selanjutnya fondasi ilmiah dari model atom ini:
Eksperimen Young: Demonstrasi pertama dualitas gelombang-partikel
Hipotesis Broglie tentang sifat subjek yang bergelombang dan sel -sel yang dapat ditunjukkan oleh eksperimen Young, juga dikenal sebagai percobaan celah ganda.
Ilmuwan Inggris Thomas Young meletakkan dasar -dasar model atom Schrödinger ketika pada tahun 1801 ia melakukan percobaan untuk memverifikasi sifat cahaya yang bergelombang.
Selama eksperimennya, Young membagi emisi sinar cahaya yang melintasi lubang kecil melalui ruang pengamatan. Divisi ini dicapai dengan menggunakan kartu 0,2 milimeter, terletak sejajar dengan balok.
Desain percobaan dilakukan agar sinar cahaya lebih lebar dari kartu, sehingga menempatkan kartu secara horizontal, balok dibagi menjadi bagian yang kira -kira sama. Keluar dari balok cahaya diarahkan oleh cermin.
Dapat melayani Anda: kekuatan jarakKedua balok cahaya menabrak dinding di ruangan yang gelap. Di sana pola gangguan antara kedua gelombang dibuktikan, yang ditunjukkan bahwa cahaya dapat berperilaku sebanyak partikel dan gelombang.

Satu abad kemudian, Albert Einsten memperkuat gagasan melalui prinsip -prinsip mekanika kuantum.
Persamaan Schrödinger
Schrödinger mengembangkan dua model matematika, membedakan apa yang terjadi tergantung pada apakah keadaan kuantum berubah dari waktu ke waktu atau tidak.
Untuk analisis atom, Schrödinger yang diterbitkan pada akhir 1926.
Ini menyiratkan bahwa gelombang tidak bergerak, node, yaitu, titik keseimbangannya, berfungsi sebagai poros bagi sisa struktur untuk bergerak di sekitarnya, menggambarkan frekuensi dan amplitudo tertentu.
Schrödinger mendefinisikan gelombang yang menggambarkan elektron sebagai status stasioner atau orbital, dan terkait, pada gilirannya, pada berbagai tingkat energi.
Persamaan waktu independen Schrödinger adalah sebagai berikut:
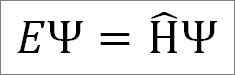
Di mana:
DAN: Konstanta proporsionalitas.
Ψ: Fungsi Gelombang Sistem Quantum.
Η ̂: Operator Hamiltonian.
Persamaan waktu independen Schrödinger digunakan ketika dapat diamati yang mewakili energi total sistem, yang dikenal sebagai operator Hamiltonian, tidak tergantung pada waktu. Namun, fungsi yang menggambarkan gerakan gelombang total akan selalu tergantung pada waktu.
Persamaan Schrödinger menunjukkan bahwa jika Anda memiliki fungsi gelombang ψ, dan operator Hamilton bekerja di atasnya, konstanta proporsionalitas dan mewakili energi total dari sistem kuantum di salah satu negara stasionernya.
Itu dapat melayani Anda: variabel diskrit: karakteristik dan contohDiterapkan pada model atom Schrödinger, jika elektron bergerak dalam ruang yang ditentukan, ada nilai energi diskrit, dan jika elektron bergeser secara bebas dalam ruang, interval energi kontinu dimiliki.
Dari sudut pandang matematika, ada beberapa solusi untuk persamaan Schrödinger, masing -masing solusi menyiratkan nilai yang berbeda untuk konstanta proporsionalitas dan.
Menurut prinsip ketidakpastian Heisenberg, tidak mungkin untuk memperkirakan posisi atau energi elektron. Akibatnya, para ilmuwan mengakui bahwa estimasi lokasi elektron dalam atom tidak akurat.
Deposulat Model Atom Schrödinger
Postulat model atom Schrödinger adalah sebagai berikut:
-Elektron berperilaku sebagai gelombang stasioner yang didistribusikan di ruang angkasa sesuai dengan fungsi gelombang ψ.
-Elektron bergerak di dalam atom yang menggambarkan orbital. Ini adalah area di mana probabilitas menemukan elektron jauh lebih tinggi. Probabilitas yang disebutkan di atas sebanding dengan kuadrat fungsi gelombang ψ2.
Konfigurasi elektronik model atom Schrödinguer menjelaskan sifat periodik atom dan tautan yang terbentuk.
Namun, model atom Schrödinger tidak merenungkan putaran elektron, dan tidak mempertimbangkan variasi elektron cepat karena efek relativistik karena efek relativistik.
Artikel yang menarik
Model Atom Broglie.
Model Atom Chadwick.
Model Atom Heisenberg.
Model Atom Perrin.
Model Atom Thomson.
Model Atom Dalton.
Dirac Jordan Atomic Model.
Model Atom Demokritus.
Model Atom Leucipo.
Model Atom Bohr.
Model Atom Sommerfeld.
Model atom saat ini.
Referensi
- Model mekanik kuantum atom yang dipulihkan dari: itu adalah.Khanacademy.org
- Persamaan Gelombang Schrödinger (s.F.). Jaime I University. Castellón, Spanyol. Dipulihkan dari: Uji.adalah
- Teori Atom Modern: Model. © ABCTE. Pulih dari: abcte.org
- Mod Atom Schrodinger.F.). Pulih dari: erwinschrodingerbiography.Weebly.com
- Wikipedia, ensiklopedia gratis. Persamaan Schrödinger. Pulih dari: is.Wikipedia.org
- Wikipedia, ensiklopedia gratis. Eksperimen Muda. Pulih dari: is.Wikipedia.org

