Model materi sel -sel
- 4609
- 280
- Mr. Darrell Streich
 Keadaan paling terkenal dari masalah ini memiliki penjelasan mereka dalam model seltickular dari masalah ini
Keadaan paling terkenal dari masalah ini memiliki penjelasan mereka dalam model seltickular dari masalah ini Apa model materi sel -selnya?
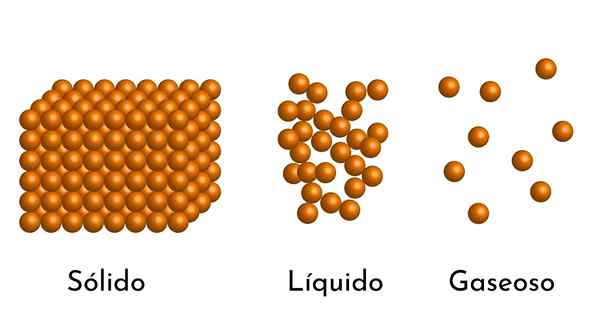
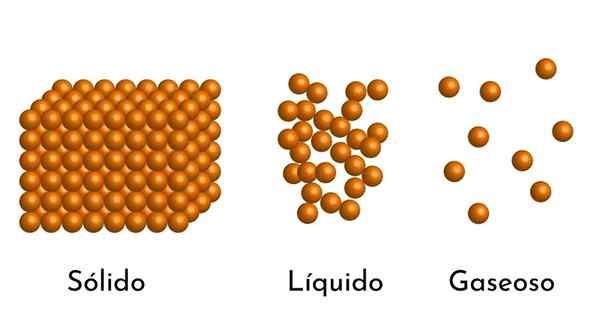
Dia Model materi sel -sel Ini adalah model struktur materi mikroskopis, yang berupaya menjelaskan sifat dan perilaku di setiap keadaan agregasi.
Postulat mendasar dari model ini adalah materi yang terdiri dari partikel -partikel kecil, yang dapat berupa atom, ion atau molekul, selalu dalam agitasi berkelanjutan.
Dalam model ini hukum mekanika klasik untuk partikel berlaku, meskipun dengan jumlah besar yang ada, mereka tidak dipelajari secara individual tetapi melalui perlakuan statistik. Dengan cara ini nilai rata -rata besarnya makroskopis yang menarik, seperti tekanan, suhu dan volume diperoleh.
Model sel -selnya juga menjelaskan sifat -sifat seperti viskositas, kekerasan, fleksibilitas dan kepadatan bahan, serta pelebaran termal, di antara fenomena lainnya.
Asal model materi sel -sel
Ide -ide tentang sifat sel yang telata dari materi tanggal setidaknya abad ke -5.C. Di Yunani Kuno, Leucipo (450 a. C. - 370 a. C.) dan Democritus (460 hingga 370 hingga C), muridnya, telah berspekulasi tentang organisasi materi di tingkat mikroskopis.
Para filsuf ini diusulkan bahwa materi ini terdiri dari partikel -partikel kecil yang tak terpisahkan, ditunjuk atom, Kata akar Yunani yang berarti persis "tidak terpisahkan".
Teori ini dikesampingkan oleh Aristoteles, sage paling berpengaruh pada masanya. Namun, baru pada abad ketujuh belas teori sel -sel mulai mengambil relevansi lagi, dan pada abad ke -19, rahasia materi akhirnya mulai terungkap.
Pada tahun 1803 ahli kimia Inggris John Dalton (1766-1844) sekali lagi mengusulkan bahwa materi ini dibentuk oleh sel-sel yang disebut atom, yang dikombinasikan dalam proporsi tertentu untuk membentuk molekul zat suatu zat.
Atom Dalton tidak dapat dipisahkan, tetapi segera struktur teoretis yang solid dikembangkan, terutama berkat James C. Maxwell (1831-1979) dan Ludwig Boltzmann (1844-1906). Ini menetapkan fondasi mekanika statistik dan fisika keadaan padat.
Itu dapat melayani Anda: kecepatan rata -rata: formula, bagaimana itu dihitung dan dipecahkanDasar -dasar model materi sel -sel
Postulat utama model adalah:
- Materi, terlepas dari status agregasi mereka, dibentuk oleh partikel mikroskopis, yang dapat berupa atom individu atau kombinasi, untuk membentuk molekul.
- Zat yang berbeda berbeda satu sama lain karena mereka dibentuk oleh partikel yang berbeda.
- Menurut keadaan agregasi materi, ada ruang kosong antara partikel, lebih besar dalam gas dan lebih kecil dalam padatan.
- Partikel -partikel yang membentuk materi ini dalam agitasi abadi. Untuk agitasi yang lebih besar, energi kinetik yang lebih besar yang mereka miliki, dan jika panas ditambahkan, pergerakan partikel meningkat.
- Juga, dalam cairan dan padatan, partikel mengalami daya tarik intensitas yang berbeda, karena gaya antarmolekul. Dalam gas, molekulnya sangat terpisah dan bergerak cepat, sehingga kekuatan ini tidak memiliki insiden yang lebih besar. Tetapi dalam cairan, yang partikelnya memiliki lebih banyak kohesi, kekuatan ini lebih intens, dan dalam padatan bahkan lebih besar.
Teori gas kinetik
Model sel -selnya diterapkan terlebih dahulu pada gas, karena merupakan keadaan agregasi dan kohesi yang paling sederhana antara molekul -molekulnya minimal. Selain itu, sifat -sifat gasnya terkenal melalui karya -karya eksperimental ahli kimia Inggris Robert Boyle dan Joseph Gay Lussac dan Jacques Charles Prancis.
Model Gas Ideal, yang paling sederhana, merenungkan bahwa:
- Ukuran partikel jauh lebih kecil dari jarak di antara mereka, dan dimensi wadah. Mereka adalah massa tertentu, yaitu, kurang dimensi dan tidak menempati volume.
- Partikel -partikel itu dalam agitasi permanen, menjadi gerakan mereka hanya terjemahannya.
- Kadang -kadang partikel berbenturan secara elastis, satu sama lain dan dengan dinding wadah. Dalam guncangan yang benar -benar elastis energi kinetik dipertahankan.
- Tidak ada kekuatan menarik antar molekul. Satu -satunya interaksi adalah karena tabrakan yang terjadi dari waktu ke waktu dan untuk waktu yang sangat singkat. Sisanya, setiap molekul bertindak terlepas dari yang lain.
- Jika tidak ada kekuatan eksternal yang bekerja pada sistem partikel, ini didistribusikan secara seragam di seluruh volume yang tersedia.
Meskipun ini adalah model paling sederhana, jelaskan perilaku gas padat pada suhu tinggi dan tekanan rendah. Para ilmuwan telah mengembangkan model lain yang lebih disesuaikan dengan perilaku gas nyata, untuk ini mereka menganggap itu:
- Molekul memiliki ukuran yang terukur.
- Kekuatan antarmolekul tidak dibatalkan.
Persamaan Gas Ideal
Berkat postulat gas ideal, ekspresi muncul yang menghubungkan besaran makroskopik dari tekanan P, volume V dan suhu T:
P ∙ V = NRT
Di mana n adalah jumlah mol gas dan r adalah konstanta universal gas, yang nilainya dalam unit sistem internasional adalah 8.314 j/mol ∙ k.
Energi dan suhu kinetik
Dalam gas yang ideal, semua energi internal memanifestasikan dirinya sebagai energi kinetik. Energi kinetik rata -rata dari molekul N dari gas ideal berbanding lurus dengan suhunya di Kelvin:
Model sel -sel dalam cairan dan padatan
Sebenarnya, semua materi dapat ditemukan di tiga keadaan paling sederhana: seperti gas, cair atau padatan, tergantung pada tekanan dan suhu. Ada negara agregasi lain seperti plasma, tetapi tidak dekat dengan permukaan bumi.
Negara -negara ini disebabkan oleh cara di mana gaya tarik antar molekul bertindak, yang pendek -range, yaitu, mereka tidak bertindak jika jarak antara molekul sangat besar dan partikel bergerak dengan kecepatan tinggi. Ini adalah kasus gas, yang memungkinkan fenomena difusi lebih cepat. Ini menjelaskan bahwa dengan mengungkap aroma, aromanya menyebar dengan cepat.
Dapat melayani Anda: apa momen magnetis?Di sisi lain, ketika partikel lebih dekat dan gerakannya lebih lambat, seperti pada cairan dan padatan, kekuatan antarmolekul ini memiliki kesempatan untuk mengerahkan tindakan mereka.
Jadi, ketika gas melewati keadaan cair, volumenya berkurang, karena jarak antara partikelnya berkurang, dan bahkan lebih ketika menjadi padat.
Materi dalam keadaan cair
Dalam keadaan cair, kekuatan antar molekul tidak tercela, tetapi bertindak dalam skala yang lebih kecil daripada di negara padat. Partikel -partikel itu membentuk kelompok kecil, yang hancur dan berkumpul kembali secara terus menerus, memberikan mobilitas untuk material, meskipun mempertahankan volume tetap.
Mobilitas ini memungkinkan cairan untuk beradaptasi dengan bentuk wadah dan memberi mereka kemampuan untuk mengalir, selain bisa mencampur lebih mudah. Difusi dapat terjadi, tetapi lebih lambat dari pada gas.
Meski begitu, partikel memiliki kohesi yang cukup sehingga cairan tetap tidak dapat dimampatkan dalam kisaran suhu yang luas.
Tegangan permukaan
Pada permukaan cairan ada molekul yang melampaui kekuatan antar molekul yang tidak seimbang, sehingga menimbulkan gaya bersih ke atas. Gaya bersih ini diminimalkan saat cairan memiliki permukaan serendah mungkin.
Berkat kekuatan ini, pin, klip, serangga, dan benda kecil lainnya berhasil tetap di permukaan air tanpa tenggelam.
 Dalam gambar ini molekul dapat dilihat di permukaan cairan, di mana gaya jaring bertindak, yang memungkinkan serangga berjalan di atas air tanpa tenggelam
Dalam gambar ini molekul dapat dilihat di permukaan cairan, di mana gaya jaring bertindak, yang memungkinkan serangga berjalan di atas air tanpa tenggelam Materi State Solid
Dalam keadaan padat partikel -partikel itu sangat dekat satu sama lain, dan gaya antarmolekul membuat partikel tetap berada pada posisi tetap. Meskipun mereka dapat bergetar di sekitar posisi ini, padatan mengadopsi bentuk yang ditentukan dan mempertahankan volume konstan mereka.
Saat panas mengalir, amplitudo gerakan getaran meningkat dan suhu meningkat. Ini menyebabkan dimensi tubuh meningkat dengan suhu, sebuah fenomena yang disebut Pelebaran termal. Jika panas yang cukup mengalir, padatan bahkan bisa masuk ke fase cair.


