Molalitas

- 2909
- 204
- Domingo Gutkowski
Apa itu Moleality?
Itu Molalitas, dilambangkan dengan huruf M dalam huruf kecil, itu adalah istilah yang digunakan untuk menggambarkan konsentrasi larutan. Itu dapat didefinisikan sebagai jumlah mol dari zat terlarut yang dilarutkan dalam 1 kilogram pelarut.
Itu sama dengan mol zat terlarut (zat yang larut) dibagi dengan kilogram pelarut (zat yang digunakan untuk larut).

Di mana mol zat terlarut diberikan oleh persamaan:
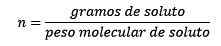
Jadi, pada akhirnya, persamaan moleity tetap ada
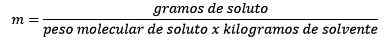
Karakteristik kebodohan
- Molalitas adalah ukuran konsentrasi zat terlarut dalam suatu larutan. Terutama digunakan saat suhu menjadi perhatian.
- Molalitas tidak umum seperti rekannya, molaritas (mol zat terlarut untuk setiap liter pelarut), tetapi digunakan dalam perhitungan yang sangat spesifik, terutama yang berkaitan dengan sifat koligatif (peningkatan titik didih, depresi titik pembekuan). Karena volume tunduk pada variasi karena suhu dan tekanan, molaritas juga bervariasi sesuai dengan suhu dan tekanan.
- Dalam beberapa kasus, penggunaan berat badan merupakan keuntungan karena massa tidak berbeda dengan kondisi lingkungan.
- Penting bahwa massa pelarut dan bukan massa solusi yang digunakan.
- Solusi yang ditandai dengan konsentrasi moral ditunjukkan dengan huruf kecil M. Solusi 1,0 m mengandung 1 mol zat terlarut per kilogram pelarut.
- Persiapan solusi moralitas yang diberikan itu mudah karena hanya membutuhkan skala yang baik. Baik pelarut dan zat terlarut dicampur, bukannya diukur dengan volume.
Itu bisa melayani Anda: asam propana- Unit SI (sistem internasional) untuk moleity adalah mol/kg, atau mol zat terlarut per kg pelarut. Solusi dengan moleity 1 mol/kg sering digambarkan sebagai "1 mol" atau "1 m".
Namun, mengikuti sistem unit SI, Institut Standar dan Teknologi Nasional, yang merupakan otoritas Amerika Serikat tentang pengukuran, menganggap bahwa istilah "moral" dan simbol unit "M" sudah usang dan menyarankan menggunakan mol/kg.
Perbedaan dan persamaan antara kebodohan (M) dan molaritas (M)
Persiapan solusi moralitas yang diberikan menyiratkan menimbang baik zat terlarut dan pelarut dan mendapatkan massanya.
Tetapi dalam kasus molaritas, volume larutan diukur, yang menyisakan ruang untuk variasi kepadatan sebagai akibat dari kondisi lingkungan dan kondisi tekanan.
Ini berarti bahwa itu adalah tekanan yang menguntungkan sementara adonan tetap tidak berubah.
Selain itu, reaksi kimia terjadi dalam proporsi massa, dan bukan volume. Untuk mengandalkan adonan, kebodohan dapat dengan mudah menjadi rasio massa atau fraksi massa.
Untuk larutan berair (solusi di mana air adalah pelarut) di dekat suhu sekitar, perbedaan antara larutan moral dan molar tercela.
Ini karena sekitar suhu sekitar, air memiliki kepadatan 1 kg / l. Ini berarti bahwa "oleh l" molaritas sama dengan "oleh kg" dari kebencian.
Itu dapat melayani Anda: kalsium kasus: struktur, sifat, memperoleh dan menggunakanUntuk pelarut seperti etanol, di mana kepadatan adalah 0,789 kg / L, solusi 1 m adalah 0,789 m.
Bagian penting dari mengingat perbedaannya adalah:
Molaritas - m → mol per liter larutan.
Molalitas - M → Mol per kilogram pelarut.
Contoh -contoh kebodohan
Contoh 1
Masalah: Apa moralitas solusi yang mengandung 0.086 mol NaCl dilarutkan dalam 25,0 g air?
Menjawab: Dalam contoh ini, persamaan moral langsung digunakan:
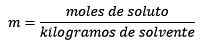
Mol zat terlarut (NaCl) = 0,086 mol
Massa (air) = 25.0 g = 25.0 x 10-3 kg
Mengganti yang Anda miliki:
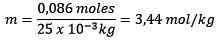
Contoh 2
Masalah: Apa moralitas solusi jika 124.2 gram NaOH larut dalam 1,00 liter air? (Kepadatan air sama dengan 1,00 g/ml).
Menjawab: Air dikenal sebagai pelarut dan kepadatan universal biasanya diberikan sekitar 1,00 gram per mililiter, atau apa yang sama, 1 kilogram per liter. Ini memfasilitasi konversi dari liter ke kilogram.
Dalam masalah ini, 124,2 gram NaOH harus dikonversi menjadi tahi lalat (untuk mol zat terlarut) dan satu liter air harus diubah menjadi kilogram (dengan kilogram pelarut) menggunakan kepadatannya.
Pertama, ada massa molar NaOH:
PMNa= 22,99 g/mol
PMSALAH SATU= 16 g/mol
PMH= 1g/mol
PMNaoh= 22,99 g/mol +16 g/mol +1 g/mol = 39,99 g/mol
Kedua, gram Naoh dikonversi menjadi tahi lalat, menggunakan adonan molar:
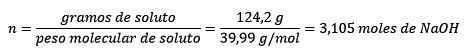
Ketiga, liter air menjadi kilogram menggunakan kepadatan:
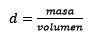
Membersihkan adonan, tetap:
Dapat melayani Anda: emas oksida (iii) (au2o3): apa itu, struktur, sifat, penggunaan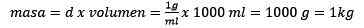
Akhirnya, persamaan molelisme diselesaikan:
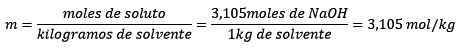
Contoh 3
Masalah: Berapa massa air dari larutan berair yang mengandung 0,52 gram barium klorida (BACL2, PM = 208,23 g/mol) yang konsentrasinya 0,005 mol/kg?
Menjawab: Dalam hal ini konsentrasi moral digunakan untuk menentukan jumlah air dalam larutan.
Pertama, jumlah mol BACL diperoleh2 Dalam solusi:
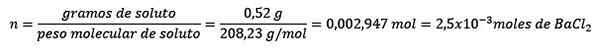
Kedua, kilogram pelarut dibersihkan dari persamaan molelisme dan diselesaikan.
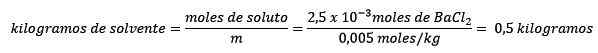
Referensi
- Menghitung Masalah Contoh Molalitas. Pulih dari ilmuwan.org.
- Apa contoh molalitas? Pulih dari Socrates.org.
- (S.F.). Moralitas. Pulih dari tanpa batas.com.

