Molekul apolar
- 1220
- 232
- Joseph Nader PhD
Itu Molekul apolar Mereka adalah mereka yang hadir dalam struktur mereka distribusi simetris elektron mereka. Ini dimungkinkan jika perbedaan elektronegativitas atomnya kecil, atau jika atom atau kelompok elektronegatif membatalkan efeknya pada molekul.
Tidak selalu "apolaritas" adalah absolut. Untuk alasan itu, molekul polaritas yang buruk dianggap apolar; Artinya, ia memiliki momen dipol μ mendekati 0. Di sini Anda memasuki bidang relatif: seberapa rendah seharusnya µ sehingga molekul atau senyawa dianggap apolar?
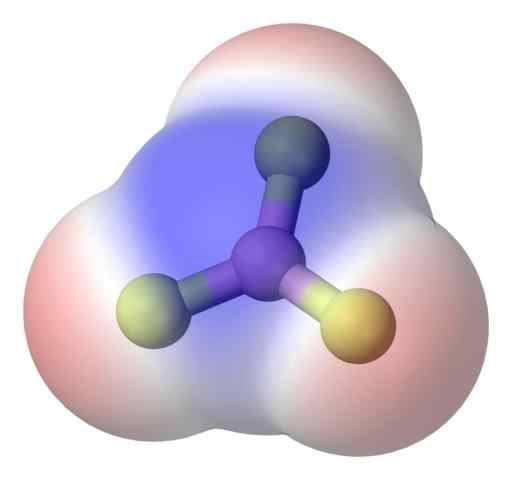
 Molekul Apolar BF3. Sumber: Benjah-BMM27 via Commons Wikimedia.
Molekul Apolar BF3. Sumber: Benjah-BMM27 via Commons Wikimedia. Untuk mengatasi masalah ini dengan lebih baik, Anda memiliki molekul boron trifluorida, bf3 (gambar atas).
Atom fluor jauh lebih elektronegatif daripada Boro, dan oleh karena itu tautan B-F adalah polar. Namun, molekul BF3 Ini adalah simetris (bidang trigonal) dan mensyaratkan pembatalan vektor dari tiga momen B-F.
Dengan demikian, molekul apolar juga dihasilkan, bahkan dengan adanya tautan kutub. Polaritas yang dihasilkan dapat diseimbangkan oleh keberadaan tautan kutub lain, dengan besarnya yang sama dengan yang sebelumnya, tetapi berorientasi pada arah yang berlawanan; seperti halnya di BF3.
Karakteristik molekul apolar
Simetri
Agar efek tautan kutub untuk membatalkan satu sama lain, molekul harus memiliki struktur geometris tertentu; Misalnya, linier, yang paling mudah dipahami pada pandangan pertama.
Ini adalah kasus karbon dioksida (CO2), yang memiliki dua tautan kutub (o = c = o). Ini karena dua momen dipol dari tautan C = O dibatalkan ketika satu berorientasi ke satu sisi, dan yang kedua menuju yang lain, pada sudut 180 °.
Dapat melayani Anda: transaminasiOleh karena itu, salah satu karakteristik pertama yang diperhitungkan ketika "apolaritas" molekul dievaluasi dengan penerbangan burung, adalah untuk mengamati seberapa simetrisnya.
Misalkan itu bukan CO2 Anda memiliki molekul cos (o = c = s), disebut karbonil sulfida.
Sekarang bukan lagi molekul apolar, karena sulfur electronegativity kurang dari oksigen; Dan karena itu, momen dipol c = S berbeda dari c = o. Akibatnya, COS adalah molekul kutub (kutub adalah tepung karung lain).
Gambar bawah secara grafis merangkum semua yang baru dijelaskan:
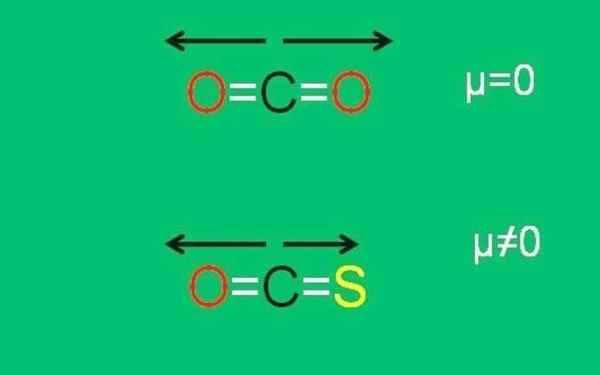 Momen dipolar xxx molekul CO2 dan COS. Sumber: Gabriel Bolívar.
Momen dipolar xxx molekul CO2 dan COS. Sumber: Gabriel Bolívar. Perhatikan bahwa momen dipol dari tautan C = S kurang dari tautan C = O dalam molekul cos.
Elektronegativitas
Elektronegativitas pada skala Pauling memiliki nilai antara 0,65 (untuk Francio), dan 4.0 (untuk fluoride). Secara umum, halogen memiliki elektronegativitas yang tinggi.
Ketika perbedaan dalam elektronegativitas unsur -unsur yang membentuk ikatan kovalen kurang dari 0,4, dikatakan bahwa itu apolar atau tidak polar. Namun, satu-satunya molekul yang benar-benar apolar adalah yang dibentuk oleh hubungan antara atom yang identik (seperti hidrogen, H-H).
Kekuatan antarmolekul
Agar suatu zat larut dalam air, ia harus berinteraksi secara elektrostatik dengan molekul; interaksi yang tidak dapat melakukan molekul apolar.
Dalam molekul apolar, muatan listriknya tidak terbatas di salah satu ujung molekul, tetapi didistribusikan secara simetris (atau secara homogen). Oleh karena itu, ia tidak dapat berinteraksi melalui pasukan dipol-dipolo.
Dapat melayani Anda: volume atomSebaliknya, molekul apolar berinteraksi satu sama lain melalui kekuatan dispersi London; Ini adalah, dipol instan yang mempolarisasi awan elektronik atom molekul tetangga. Di sini massa molekul merupakan faktor dominan dalam sifat fisik molekul ini.
Bagaimana mengidentifikasi molekul apolar?
-Mungkin salah satu metode terbaik untuk mengidentifikasi molekul apolar adalah kelarutannya dalam pelarut polar yang berbeda, umumnya sedikit larut di dalamnya.
-Secara umum, molekul apolar bersifat gas. Mereka juga bisa menjadi cairan yang tidak terlihat dengan air.
-Padatan apolar ditandai dengan menjadi lunak.
-Kekuatan dispersi yang membuat mereka tetap bersama biasanya lemah. Karena itu, titik leleh atau mendidihnya cenderung lebih rendah daripada senyawa kutub.
-Molekul apolar, terutama dalam bentuk cair, adalah konduktor listrik yang buruk, karena mereka tidak memiliki muatan listrik bersih.
Contoh molekul apolar
gas mulia
Meskipun bukan molekul, gas mulia dianggap apolar. Jika diasumsikan bahwa dua atomnya berinteraksi untuk periode waktu yang singkat, interaksi ini dapat dianggap (setengah) sebagai molekul; molekul itu akan menjadi sifat apolar.
Molekul diatomik
Molekul diatomik, seperti h2, BR2, The i2, Cl2, o2, dan f2, Mereka apolar. Ini umumnya2, A A.
Hidrokarbon
Bagaimana jika itu adalah sekelompok atom? Itu akan sebelum senyawa apolar lainnya; Misalnya, Ethane, Cho3-Ch3, kerangka karbonnya linier, c-c.
Metano, ch4, dan etana, c2H6, Mereka adalah molekul apolar. Karbon memiliki elektronegativitas 2,55; Sedangkan elektronegativitas hidrogen adalah 2.2. Oleh karena itu, ada vektor dipol intensitas rendah, berorientasi dari hidrogen ke karbon.
Itu dapat melayani Anda: Metode Mohr: Fundamental, Reaksi, Prosedur, PenggunaanTetapi, karena simetri geometris molekul metana dan etana, jumlah vektor dipol atau momen dipol dalam molekulnya batal, jadi tidak ada beban bersih dalam molekul.
Secara umum, hal yang sama terjadi dengan semua hidrokarbon, dan bahkan ketika ada tidak jenuh di dalamnya (ikatan ganda dan tiga), mereka dianggap apolar atau senyawa dari polaritas rendah. Juga, hidrokarbon siklik adalah molekul apolar, seperti sikloheksan atau siklobutane.
Yang lain
Molekul karbon dioksida (CO2) dan karbon disulfida (CS2) Mereka adalah molekul apolar, keduanya dengan geometri linier.
Dalam karbon disulfida, karbon electronegativity adalah 2,55, sedangkan sulfur electronegativity adalah 2,58; Jadi kedua elemen memiliki, secara praktis, elektronegativitas yang sama. Tidak ada generasi vektor dipol dan oleh karena itu, beban bersih nol.
Juga, molekul CCL berikut tersedia4 dan ALBR3, keduanya apolar:
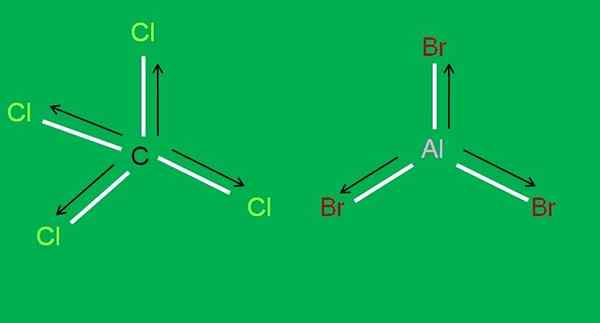 Molekul CCL4 dan ALBR3. Sumber: Gabriel Bolívar.
Molekul CCL4 dan ALBR3. Sumber: Gabriel Bolívar. Di Aluminium Tribromide, Albb3 Hal yang sama terjadi dengan BF3, Di awal artikel. Sementara itu, untuk karbon tetrachloride, CCL4, Geometri adalah tetrahedral dan simetris, karena semua tautan C-CL sama.
Demikian pula, molekul dengan formula umum CX4 (CF4, Ci4 dan cbr4), mereka juga apolar.
Dan akhirnya, molekul apolar bahkan dapat memiliki geometri oktahedral, seperti halnya dengan sulfur hexafluoride, sf6. Faktanya, Anda dapat memiliki geometri atau struktur apa pun, asalkan simetris dan distribusi elektroniknya homogen.
Referensi
- Molekul nonpolar. Dipulihkan dari: Kimia.Tutorvista.com
- Contoh molekul kutub dan nonpolar. Pulih dari: thinkco.com
- « Saldo materi apa itu, persamaan umum, tipe
- Daniel Servitje Montull Biografi, Kepemimpinan dan Kontribusi »

