Momen dipolar bagaimana itu dihitung dan contohnya

- 5020
- 961
- Joseph Nader PhD
Dia Momen dipolar Ini adalah sifat kimia yang menunjukkan seberapa heterogen muatan listrik didistribusikan dalam molekul. Itu diekspresikan dalam unit debye, 3.33 · 10-30 C · m, dan biasanya nilainya berkisar dari 0 hingga 11 D.
Senyawa yang sangat polar cenderung memiliki momen dipol yang besar; Sedangkan apolar, momen dipol kecil. Semakin terpolarisasi muatan listrik dalam molekul, semakin besar momen dipolnya; yaitu, harus ada daerah yang kaya elektron, Δ-, dan orang miskin lainnya dalam elektron, Δ+.
 Dua -draft warna berfungsi sebagai analogi dengan dua kutub, positif dan negatif, dari molekul dengan momen dipol yang ditandai. Sumber: Pexels.
Dua -draft warna berfungsi sebagai analogi dengan dua kutub, positif dan negatif, dari molekul dengan momen dipol yang ditandai. Sumber: Pexels. Momen dipol, μ, adalah besarnya vektor, sehingga dipengaruhi oleh sudut tautan dan, secara umum, oleh struktur molekul.
Saat molekulnya linier, itu dapat dibandingkan dengan draft dua warna. Ujung negatifnya Δ-, itu akan sesuai dengan warna merah; Sedangkan yang positif, Δ+, akan menjadi warna biru. Karena besaran beban negatif meningkat pada Δ- kutub, dan jarak yang memisahkannya dari Δ+, momen dipol meningkat.
Secara kimia di atas berarti bahwa semakin besar perbedaan elektronegativitas antara dua atom, dan semakin lama jarak yang memisahkannya, semakin besar momen dipol di antara mereka.
[TOC]
Bagaimana momen dipol dihitung?
Ini dianggap sebagai hubungan kovalen antara dua atom, A dan B:
A-B
Jarak antara beban parsial positif dan negatif sudah ditentukan oleh panjang tautannya:
KEδ+-Bδ-
Karena proton dan elektron memiliki besarnya muatan listrik yang sama tetapi dengan tanda -tanda yang berlawanan, 1.6 · 10-19C, ini yang diperhitungkan saat mengevaluasi momen dipol antara A dan B melalui persamaan berikut:
Itu dapat melayani Anda: Perbedaan antara senyawa organik dan anorganikμ = Δ ·D
Di mana μ adalah momen dipol, Δ adalah beban elektron tanpa tanda negatif, dan D Panjang tautan yang diekspresikan dalam meter. Misalnya, dengan asumsi itu D Ini memiliki nilai 2 Å (1 · 10-10m) Momen dipol, μA-B akan menjadi:
μA-B = (1.6 · 10-19C) · (2 · 10-10M)
= 3.2 · 10-29C · m
Tetapi karena nilai ini sangat kecil, unit Deby digunakan:
μ = (3.2 · 10-29C · m) · (1 d/3.33 · 10-30 C · m)
= 9.60 d
Nilai μA-B ini dapat mengasumsikan bahwa tautan A-B lebih ion dari kovalen.
Contoh
Air
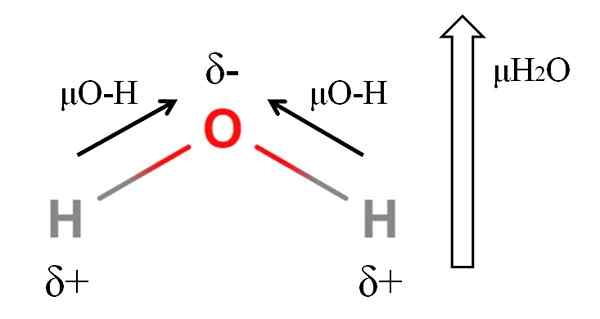 Momen dipoar molekul air. Sumber: Gabriel Bolívar.
Momen dipoar molekul air. Sumber: Gabriel Bolívar. Untuk menghitung momen dipol molekul, Anda harus menambahkan semua momen dipol dari tautan masing -masing, mengingat sudut tautan dan trigonometri kecil. Ini pada awalnya.
Air memiliki salah satu momen dipol terbesar yang bisa diharapkan untuk senyawa kovalen. Pada gambar atas kita memiliki atom hidrogen memiliki beban parsial positif, Δ+, sedangkan oksigen membawa beban parsial negatif, Δ-. Tautan O-H cukup polar (1.5d), dan ada dua dari mereka dalam molekul H2SALAH SATU.
Secara umum, vektor diambil dari atom elektronegatif yang kurang (H) ke yang paling elektronegatif (O). Meskipun tidak ditarik, pada atom oksigen ada dua pasang elektron yang tidak dibagikan, yang "berkonsentrasi" wilayah negatif lebih.
Karena geometri sudut h2Atau, momen dipol bergabung ke arah atom oksigen. Perhatikan bahwa jumlah dari dua μo-h akan memberikan 3D (1.5+1.5); Tapi tidak seperti itu. Momen dipol air memiliki nilai eksperimental 1.85d. Berikut adalah efek dari sudut dekat 105º antara tautan H-O-H.
Itu dapat melayani Anda: termometer laboratorium: karakteristik, untuk apa, penggunaan, contohMetanol
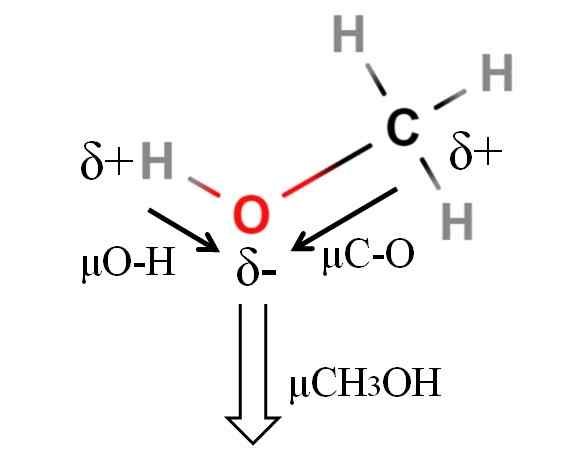 Momen dipoar molekul metanol. Sumber: Gabriel Bolívar.
Momen dipoar molekul metanol. Sumber: Gabriel Bolívar. Momen dipol metanol adalah 1.69d. Kurang dari air. Oleh karena itu, massa atom tidak memiliki terlalu banyak pengaruh pada saat dipol; Tapi radio atomnya. Dalam kasus metanol, kami tidak dapat menegaskan bahwa tautan H-O Anda memiliki μ sama dengan 1.5 d; Karena, lingkungan molekuler berbeda di CHO3Oh dan h2SALAH SATU.
Itulah sebabnya kita harus mengukur panjang tautan H-O dalam metanol untuk dapat menghitung μo-h. Apa yang dapat ditegaskan adalah bahwa μo-h lebih besar dari μC-O.
Metanol dikatalogkan sebagai salah satu pelarut paling polar yang dapat ditemukan bersama dengan air dan amonia.
Amonia
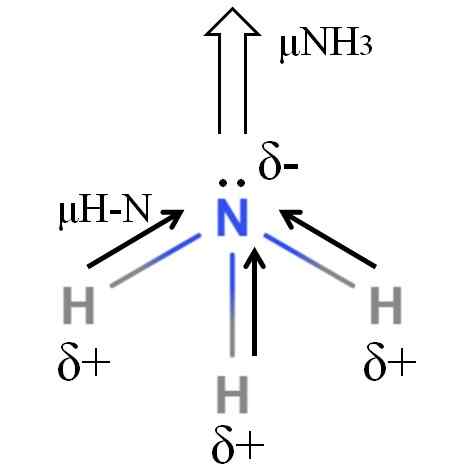 Momen dipoar molekul amonia. Sumber: Gabriel Bolívar.
Momen dipoar molekul amonia. Sumber: Gabriel Bolívar. Ikatan H-N cukup polar, jadi nitrogen mengikuti elektronegativitas yang lebih besar menarik elektron ke arah dirinya sendiri (gambar superior). Selain itu, padanya kami memiliki beberapa elektron yang tidak ada, yang berkontribusi beban negatif mereka ke wilayah Δ-. Oleh karena itu, muatan listrik mendominasi dalam atom nitrogen amonia.
Amonia memiliki momen dipol 1.42d, kurang dari metanol. Jika amonia dan metanol dapat diubah menjadi draft, akan terlihat bahwa rancangan metanol memiliki lebih banyak kutub yang ditentukan dibandingkan dengan draft amonia.
Etanol
Dalam kasus etanol, cho3Ch2Oh momen dipol Anda sangat dekat dengan metanol, tetapi cenderung memiliki nilai yang lebih rendah. Memiliki lebih banyak atom karbon yang menyusun wilayah Δ+, atom oksigen yang mewakili Δ-, mulai kehilangan sedikit "intensitas negatif relatif".
Dapat melayani Anda: dimethylamine ((ch3) 2nh): struktur, sifat, penggunaan, risikoKarbon dioksida
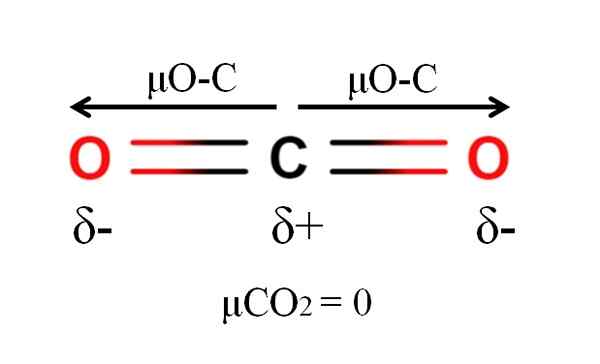 Momen dipoar molekul karbon dioksida. Sumber: Gabriel Bolívar.
Momen dipoar molekul karbon dioksida. Sumber: Gabriel Bolívar. Karbon dioksida memiliki dua ikatan kutub, c = o, dengan momen dipol masing-masing μo-c. Namun, seperti yang dapat dilihat pada gambar superior, geometri linier CO2 Membuat dua μo-C secara vektor membatalkan satu sama lain, bahkan jika karbon memiliki beban parsial positif dan beban parsial negatif oksigen.
Untuk alasan ini, karbon dioksida adalah molekul apolar, karena μCO2 memiliki nilai 0D.
Metana
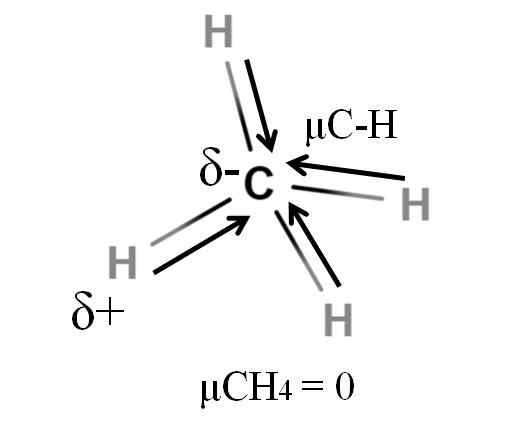 Momen dipolar untuk molekul metana. Sumber: Gabriel Bolívar.
Momen dipolar untuk molekul metana. Sumber: Gabriel Bolívar. Baik metana dan karbon dioksida berbagi kesamaan: mereka adalah molekul yang sangat simetris. Secara umum, semakin simetris A molekul, semakin sedikit momen dipolnya.
Jika kita melihat molekul Cho4, Ikatan C-H-nya adalah kutub, dan elektron diarahkan ke atom karbon karena mereka sedikit lebih elektronegatif. Dapat dianggap bahwa karbon harus menjadi wilayah Δ yang sangat negatif; Sebagai draf dengan pusat merah yang intens dan ujung kebiruannya.
Namun, saat CHO dibagi4 Di setengahnya kami akan mendapatkan dua bagian H-H-H, satu di sebelah kiri dan yang lain di sebelah kanan, mirip dengan molekul h2SALAH SATU. Dengan demikian, momen dipol yang dihasilkan dari menambahkan dua μC-H ini dibatalkan dengan setengah lainnya. Dan karena itu, μch4 memiliki nilai 0D.
Referensi
- Whitten, Davis, Peck & Stanley. (2008). Kimia. (Edisi ke -8.). Pembelajaran Cengage.
- Walter J. Moore. (1963). Kimia Fisik. Dalam Kinetika Kimia. Edisi Keempat, Longmans.
- Iran. Levine. (2009). Prinsip -prinsip fisikokimia. Edisi Keenam, Halaman 479-540. MC Graw Hill.
- Helmestine, Anne Marie, PH.D. (29 Januari 2020). Definisi momen dipol. Pulih dari: thinkco.com
- Blaber Mike. (29 September 2019). Momen dipol. Libretteks Kimia. Pulih dari: chem.Librettexts.org
- Larita Williams. (2020). Momen Dipol: Definisi, Persamaan & Contoh. Belajar. Pulih dari: belajar.com
- Wikipedia. (2020). Momen dipol ikatan. Diperoleh dari: di.Wikipedia.org
- « Gaslighting Cara Mendeteksinya dan 5 Tips Untuk menghindarinya
- Onomatopoeia Karakteristik, fungsi, jenis, contoh »

