Langkah -langkah metode keseimbangan redoks, contoh, latihan
- 3599
- 408
- Herbert Fritsch
Dia Metode penyeimbang redoks Ini adalah salah satu yang memungkinkan untuk menyeimbangkan persamaan kimia reaksi redoks, yang seharusnya menjadi sakit kepala. Di sini satu atau lebih spesies bertukar elektron; Yang menyumbang atau kehilangan mereka disebut spesies oksidan, sedangkan yang menerima atau memenangkannya, spesies reduktif.
Dalam metode ini, penting untuk mengetahui jumlah oksidasi spesies ini, karena mereka mengungkapkan berapa banyak elektron yang telah diperoleh atau hilang oleh mol. Berkat ini, dimungkinkan untuk menyeimbangkan muatan listrik dengan menulis dalam persamaan elektron seolah -olah mereka reaktan atau produk.
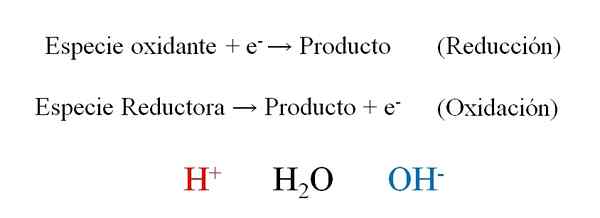
 Semi -Reaches dari reaksi redoks dengan tiga protagonis selama keseimbangan mereka: H+, H2O dan OH-. Sumber: Gabriel Bolívar.
Semi -Reaches dari reaksi redoks dengan tiga protagonis selama keseimbangan mereka: H+, H2O dan OH-. Sumber: Gabriel Bolívar. Gambar superior menunjukkan bagaimana elektron secara efektif, dan- Mereka ditempatkan sebagai reagen ketika spesies pengoksidasi memenangkannya; Dan sebagai produk saat spesies pereduksi kehilangan mereka. Perhatikan bahwa untuk menyeimbangkan jenis persamaan ini, perlu menguasai konsep oksidasi dan angka oksidasi.
Spesies h+, H2Atau dan oh-, Tergantung pada pH media reaksi, memungkinkan penyeimbangan redoks, jadi sangat umum untuk menemukannya dalam latihan. Jika mediumnya asam, kita beralih ke h+; Tetapi jika sebaliknya media adalah dasar, maka kami menggunakan OH- Untuk menyeimbangkan.
Sifat reaksi itu sendiri menentukan apa pH medium. Itulah sebabnya, meskipun dapat diseimbangkan dengan mengasumsikan asam atau media basa, persamaan seimbang akhir akan menunjukkan apakah ion h tidak mungkin atau tidak benar -benar benar -benar+ dan oh-.
[TOC]
Langkah
- Umum
Periksa nomor oksidasi reagen dan produk
Misalkan persamaan kimia berikut:
Cu (S) + Agno3(AC) → Cu (Tidak3)2 + Ag (s)
Ini sesuai dengan reaksi redoks, di mana perubahan dalam jumlah oksidasi reagen terjadi:
Cu0(S) + Ag+TIDAK3(AC) → Cu2+(TIDAK3)2 + Ag (s)0
Identifikasi spesies pengoksidasi dan reduktif
Spesies pengoksidasi memperoleh elektron yang mengoksidasi spesies pereduksi. Oleh karena itu, jumlah oksidasi berkurang: menjadi kurang positif. Sementara itu, jumlah oksidasi spesies pereduksi meningkat, karena kehilangan elektron: menjadi lebih positif.
Dengan demikian, dalam reaksi sebelumnya tembaga teroksidasi, karena dilewati dari Cu0 ke Cu2+; Dan perak dikurangi, karena pergi dari AG+ A Ag0. Tembaga adalah spesies pereduksi, dan perak spesies pengoksidasi.
Tuliskan atom dan beban semi -reaksi dan keseimbangan
Mengidentifikasi spesies mana yang mendapatkan atau kehilangan elektron, redoks semi -reaksi ditulis untuk reaksi reduksi dan oksidasi:
Cu0 → Cu2+
Ag+ → Ag0
Tembaga kehilangan dua elektron, sementara perak menang satu. Kami menempatkan elektron di kedua reaksi semi:
Dapat melayani Anda: kalium fosfat (k3po4): struktur, sifat, penggunaanCu0 → Cu2+ + 2e-
Ag+ + Dan- → Ag0
Perhatikan bahwa beban tetap seimbang di kedua reaksi semi; Tetapi jika mereka ditambahkan, hukum konservasi materi akan dilanggar: jumlah elektron harus sama dalam dua reaksi semi. Oleh karena itu, persamaan kedua dikalikan dengan 2 dan dua persamaan ditambahkan:
(Cu0 → Cu2+ + 2e-) x 1
(Ag+ + Dan- → Ag0) x 2
Cu0 + 2ag+ + 2e- → Cu2+ + 2ag0 + 2e-
Elektron dibatalkan karena berada di sisi reagen dan produk:
Cu0 + 2ag+ → Cu2+ + 2ag0
Ini adalah persamaan ionik global.
Ganti koefisien persamaan ionik dalam persamaan umum
Akhirnya, koefisien stoikiometrik dari persamaan sebelumnya pindah ke persamaan pertama:
Cu + 2agno3(AC) → Cu (Tidak3)2 + 2ag
Perhatikan bahwa 2 diposisikan dengan Agno3 Karena dalam garam ini perak seperti AG+, Dan hal yang sama berlaku untuk CU (tidak3)2. Jika persamaan ini tidak seimbang pada akhirnya, skor dibuat.
Persamaan yang diusulkan dalam langkah -langkah sebelumnya bisa diseimbangkan secara langsung oleh Tanteo. Namun, ada reaksi redoks yang membutuhkan media asam (h+) atau dasar (oh-) untuk berlangsung. Ketika ini terjadi, tidak dapat seimbang dengan asumsi bahwa mediumnya netral; karena baru saja ditampilkan (tidak ditambahkan atau h+ Dan oh-).
Di sisi lain, lebih mudah mengetahui bahwa semi -reaksi menulis atom, ion atau senyawa (kebanyakan oksida) di mana perubahan dalam bilangan oksidasi terjadi. Ini akan disorot di bagian Latihan.
- Menyeimbangkan dalam medium asam
Saat mediumnya asam, Anda harus berhenti di dua reaksi semi. Kali ini pada saat keseimbangan kita mengabaikan atom oksigen dan hidrogen, dan juga elektron. Elektron akan menyeimbangkan di akhir.
Kemudian, di sisi reaksi dengan lebih sedikit atom oksigen, kami menambahkan molekul air untuk mengkompensasinya. Di sisi lain, kami menyeimbangkan hidrogen dengan ion H+. Dan akhirnya, kami menambahkan elektron dan melanjutkan mengikuti langkah -langkah umum yang sudah terpapar.
- Menyeimbangkan dalam media dasar
Ketika media adalah dasar, itu sama seperti di lingkungan asam dengan perbedaan kecil: kali ini di sisi di mana ada lebih banyak oksigen, molekul air yang sama dengan kelebihan oksigen ini akan ditemukan; Dan di sisi lain, oh ion- Untuk mengimbangi hidrogen.
Akhirnya, keseimbangan elektron, dua reaksi semi ditambahkan, dan koefisien persamaan ionik global dalam persamaan umum diganti.
Dapat melayani Anda: sistem yang tersebar: jenis, karakteristik, dan contohContoh
Persamaan redoks berikut tanpa keseimbangan dan seimbang berfungsi sebagai contoh untuk mengamati berapa banyak perubahan setelah menerapkan metode penyeimbangan ini:
P4 + Clo- → PO43- + Cl- (tanpa keseimbangan)
P4 + 10 clo- + 6 h2O → 4 po43- + 10 Cl- + 12 jam+ (Asam setengah seimbang)
P4 + 10 clo- + 12 Oh- → 4 PO43- + 10 Cl- + 6 h2O (medium dasar seimbang)
yo2 + Kno3 → i- + Kio3 + TIDAK3- (tanpa keseimbangan)
3i2 + Kno3 + 3H2O → 5i- + Kio3 + TIDAK3- + 6h+ (Asam setengah seimbang)
Cr2SALAH SATU27- + Hno2 → Cr3+ + TIDAK3- (tanpa keseimbangan)
3no2 + 5H+ + Cr2SALAH SATU27- → 3no3- +2cr3+ + 4H2O (keseimbangan asam seimbang)
Latihan
Latihan 1
Seimbangkan persamaan berikut dalam media dasar:
yo2 + Kno3 → i- + Kio3 + TIDAK3-
Langkah Umum
Kami mulai dengan menulis nomor oksidasi spesies yang kami duga berkarat atau berkurang; Dalam hal ini, atom yodium:
yo20 + Kno3 → i- + Ki5+SALAH SATU3 + TIDAK3-
Perhatikan bahwa yodium teroksidasi dan pada saat yang sama berkurang, jadi kami melanjutkan untuk menulis dua reaksi semi masing -masing:
yo2 → i- (Pengurangan, untuk setiap i- 1 elektron dikonsumsi)
yo2 → IO3- (Oksidasi, untuk setiap IO3- 5 elektron dilepaskan)
Dalam semi -cahaya oksidasi kami menempatkan anion io3-, dan bukan pada atom yodium seperti saya5+. Kami menyeimbangkan atom yodium:
yo2 → 2i-
yo2 → 23-
Menyeimbangkan dalam media dasar
Sekarang kami fokus pada berayun dalam media dasar semi -reaksi oksidasi, karena memiliki spesies teroksigenasi. Kami menambahkan sisi produk dengan jumlah molekul air yang sama seperti atom oksigen:
yo2 → 23- + 6h2SALAH SATU
Dan di sisi kiri kami menyeimbangkan hidrogen dengan oh-:
yo2 + 12oh- → 23- + 6h2SALAH SATU
Kami menulis dua reaksi semi dan menambahkan elektron yang hilang untuk menyeimbangkan beban negatif:
yo2 + 2e- → 2i-
yo2 + 12oh- → 23- + 6h2O + 10e-
Kami mencocokkan kedua nomor elektron di kedua reaksi semi dan menambahkannya:
(YO2 + 2e- → 2i-) x 10
(YO2 + 12oh- → 23- + 6h2O + 10e-) x 2
12i2 + 24 oh- + 20e- → 20i- + 43- + 12h2O + 20e-
Elektron dibatalkan dan dibagi semua koefisien dengan empat untuk menyederhanakan persamaan ionik global:
(12i2 + 24 oh- → 20i- + 43- + 12h2O) x ¼
3i2 + 6OH- → 5i- + Io3- + 3H2SALAH SATU
Dan akhirnya, kami mengganti koefisien persamaan ionik dalam persamaan pertama:
3i2 + 6OH- + Kno3 → 5i- + Kio3 + TIDAK3- + 3H2SALAH SATU
Itu dapat melayani Anda: kekuatan ionik: unit, cara menghitungnya, contohPersamaannya sudah seimbang. Bandingkan hasil ini dengan penyeimbangan dalam media asam Contoh 2.
Latihan 2
Seimbangkan persamaan berikut dalam medium asam:
Keyakinan2SALAH SATU3 + Co → Fe + Co2
Langkah Umum
Kami mengamati jumlah oksidasi zat besi dan karbon untuk mengetahui mana dari keduanya yang telah teroksidasi atau dikurangi:
Keyakinan23+SALAH SATU3 + C2+O → Iman0 + C4+SALAH SATU2
Zat besi telah berkurang, jadi itu adalah spesies pengoksidasi. Sementara itu, karbon memiliki berkarat, berperilaku seperti spesies pereduksi. Semi -reaksi untuk oksidasi dan redisi tentang adalah:
Keyakinan23+SALAH SATU3 → Iman0 (Pengurangan, untuk setiap iman 3 elektron dikonsumsi)
CO → CO2 (Oksidasi, untuk setiap CO2 2 elektron dilepaskan)
Perhatikan bahwa kita menulis oksida, iman2SALAH SATU3, Karena mengandung iman3+, Bukan hanya menempatkan iman3+. Kami menyeimbangkan atom yang dibutuhkan kecuali oksigen:
Keyakinan2SALAH SATU3 → 2fe
CO → CO2
Dan penyeimbangan dilakukan dalam asam di kedua reaksi semi, karena ada spesies teroksigenasi di antaranya.
Menyeimbangkan dalam medium asam
Kami menambahkan air untuk menyeimbangkan oksigen, dan kemudian h+ Untuk menyeimbangkan hidrogen:
Keyakinan2SALAH SATU3 → 2fe + 3h2SALAH SATU
6h+ + Keyakinan2SALAH SATU3 → 2fe + 3h2SALAH SATU
Co + h2O → co2
Co + h2O → co2 + 2h+
Sekarang kami menyeimbangkan beban dengan menempatkan elektron yang terlibat dalam semi -reaksi:
6h+ + 6e- + Keyakinan2SALAH SATU3 → 2fe + 3h2SALAH SATU
Co + h2O → co2 + 2h+ + 2e-
Kami cocok dengan jumlah elektron di kedua reaksi semi dan menambahkannya:
(6h+ + 6e- + Keyakinan2SALAH SATU3 → 2fe + 3h2O) x 2
(Co + h2O → co2 + 2h+ + 2e-) x 6
12 jam+ + 12e- + 2fe2SALAH SATU3 + 6co + 6h2O → 4fe + 6h2O + 6co2 + 12h+ + 12e-
Kami membatalkan elektron, ion H+ Dan molekul air:
2fe2SALAH SATU3 + 6co → 4fe +6co2
Tetapi koefisien ini dapat dibagi dengan dua untuk menyederhanakan persamaan lebih banyak lagi, memiliki: memiliki:
Keyakinan2SALAH SATU3 + 3co → 2fe +3co2
Pertanyaan ini muncul: penyeimbangan redoks untuk persamaan ini diperlukan? Oleh tanteo itu akan jauh lebih cepat. Ini menunjukkan bahwa reaksi ini berlanjut secara bergantian dari pH medium.
Referensi
- Whitten, Davis, Peck & Stanley. (2008). Kimia. (Edisi ke -8.). Pembelajaran Cengage.
- Helmestine, Anne Marie, PH.D. (22 September 2019). Bagaimana menyeimbangkan reaksi redoks. Pulih dari: thinkco.com
- Ann Nguyen & Luvleen Brar. (5 Juni 2019). Balancing reaksi redoks. Libretteks Kimia. Pulih dari: chem.Librettexts.org
- Quimitube. (2012). Latihan 19: Penyesuaian reaksi redoks dalam media dasar dengan dua reaksi semi oksidasi. Dipulihkan dari: Quimitube.com
- Universitas Washington di ST. Louis. (S.F.). Praktik Masalah: Reaksi Redoks. Dipulihkan dari: Kimia.Wustl.Edu
- John Wiley & Sons. (2020). Bagaimana menyeimbangkan persamaan redoks. Pulih dari: boneka.com
- Rubén Darío atau. G. (2015). Menyeimbangkan persamaan kimia. Pulih dari: belajar di linea.Anda.Edu.bersama
- « Ketidaksetaraan dan Gerakan Sosial di Meksiko (1950-1980)
- Fundamental Metode Mohr, Reaksi, Prosedur, Penggunaan »

