Tembaga nitrat (ii)
- 1901
- 483
- Frederick Pfeffer
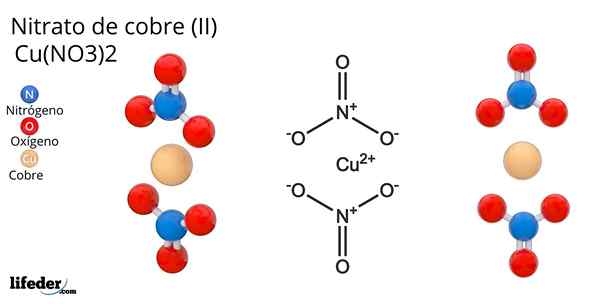
 Formula dan Struktur Tembaga Nitrat (II)
Formula dan Struktur Tembaga Nitrat (II) Dia nitrat tembaga (Ii) atau cupric nitrate, yang formula kimianya adalah Cu (tidak3)2, Ini adalah garam anorganik yang cemerlang dan warna biru-hijau yang menarik. Ini disintesis pada skala industri dari dekomposisi mineral tembaga, termasuk Gerhardita dan rouaita mineral.
Metode lain yang lebih layak, dalam hal bahan baku dan jumlah garam yang diinginkan, terdiri dari reaksi langsung dengan tembaga logam dan senyawa yang diturunkan. Saat tembaga bersentuhan dengan larutan asam nitrat terkonsentrasi (HNO3), reaksi redoks terjadi.
Dalam reaksi ini tembaga teroksidasi dan nitrogen berkurang sesuai dengan persamaan kimia berikut:
Cu (S) + 4Hno3(conc) => cu (tidak3)2(Ac) + 2h2Atau (l) + 2no2(G)
Nitrogen dioksida (tidak2) adalah gas coklat dan berbahaya; Solusi berair yang dihasilkan adalah kebiruan. Tembaga dapat membentuk ion cuprous (Cu+), Ion cupric (Cu2+) atau cu ion yang paling tidak umum3+; Namun, ion cuprous tidak disukai dalam media berair oleh banyak faktor elektronik, energi dan geometris.
Potensi pengurangan standar untuk Cu+ (0,52V) lebih besar dari untuk Cu2+ (0.34v), yang berarti bahwa Cu+ Lebih tidak stabil dan cenderung memenangkan elektron untuk menjadi cu (s). Ukuran elektrokimia ini menjelaskan mengapa tidak ada cuno3 sebagai produk reaksi, atau setidaknya dalam air.
[TOC]
Properti Nitrat Tembaga
 Penampilan tembaga nitrat (ii) triohidrat
Penampilan tembaga nitrat (ii) triohidrat Tembaga nitrat adalah anhidrida (kering) atau terhidrasi dengan proporsi air yang berbeda. Anhydride adalah cairan biru, tetapi setelah berkoordinasi dengan molekul air - mampu membentuk jembatan hidrogen - mengkristalisasi bagaimana Cu (tidak3)2· 3H2O o cu (tidak3)2· 6h2SALAH SATU. Ini adalah tiga bentuk garam yang paling tersedia di pasaran.
Itu dapat melayani Anda: Helmholtz Free Energy: Unit, bagaimana itu dihitung, latihan terpecahkanBerat molekul untuk garam kering adalah 187,6 g/mol, menambah nilai ini 18 g/mol untuk setiap molekul air yang dimasukkan ke dalam garam. Kepadatannya sama dengan 3,05 g/ml, dan berkurang dengan masing-masing molekul air bawaan: 2,32 g/mL untuk garam tri-hidrasi, dan 2,07 g/ml untuk garam hexa yang dihidrasi hexa. Tidak ada titik mendidih, tapi sublima.
Tiga bentuk tembaga nitrat sangat larut dalam air, amonia, dioksan dan etanol. Titik -titik lelehnya turun sebagai molekul lain ditambahkan ke lingkup koordinasi eksternal tembaga; Fusi diikuti oleh dekomposisi termal tembaga nitrat, menghasilkan gas berbahaya dari NO2:
2 cu (tidak3)2(s) => 2 cuo (s) + 4 tidak2(g)+ atau2(G)
Persamaan kimia di atas adalah untuk garam anhidrida; Untuk garam terhidrasi, uap air juga akan terjadi di sisi kanan persamaan.
Konfigurasi elektronik
Konfigurasi Elektronik untuk Ion Cu2+ Itu adalah [ar] 3d9, menyajikan paramagnetisme (elektron dalam orbital 3D9 hilang).
Karena tembaga adalah logam transisi dari periode keempat dari tabel periodik, dan telah kehilangan dua elektron valencia per aksi HNO3, Masih memiliki orbital 4S dan 4P yang tersedia untuk membentuk obligasi kovalen. Bahkan lebih, Cu2+ Anda dapat menggunakan dua orbital 4D terluar untuk dapat mengoordinasikan hingga enam molekul.
Anion no3- Mereka datar, dan untuk Cu2+ Anda dapat berkoordinasi dengan mereka harus memiliki hibridisasi SP3D2 Itu memungkinkan Anda untuk mengadopsi geometri oktahedral; Ini mencegah anion dari tidak3- menjadi "memukul" di antara mereka.
Ini dapat melayani Anda: Formula Kental: Apa itu dan contoh (metana, etana, glukosa ...)Ini dicapai oleh Cu2+, menempatkan mereka di pesawat persegi di sekitar dirinya sendiri. Konfigurasi yang dihasilkan untuk atom Cu dalam garam adalah: [ar] 3d94s24p6.
Struktur kimia
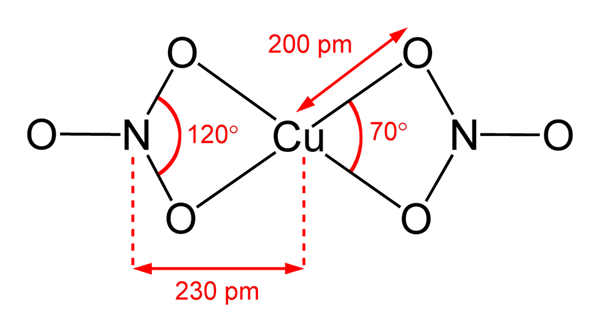 Struktur Nitrat Tembaga (II)
Struktur Nitrat Tembaga (II) Dalam gambar superior molekul Cu terisolasi diwakili (tidak3)2 dalam fase gas. Atom oksigen anion nitrat secara langsung dikoordinasikan dengan pusat tembaga (bidang koordinasi internal), membentuk empat ikatan Cu-O.
Ini memiliki geometri molekul bidang persegi. Pesawat ditarik oleh bola merah di simpul dan bola tembaga di tengah. Interaksi fase gas sangat lemah karena tolakan elektrostatik antara kelompok tidak3-.
Namun, dalam fase padat pusat tembaga membentuk tautan logam -cu-cu-, membuat rantai tembaga polimer.
Molekul air dapat membentuk jembatan hidrogen dengan kelompok tidak3-, dan ini akan menawarkan jembatan hidrogen untuk molekul air lainnya, dan seterusnya sampai bola air di sekitar Cu (tidak3)2.
Dalam bidang ini dapat memiliki 1 hingga 6 tetangga eksternal; Karenanya garam mudah terhidrasi untuk menghasilkan garam Tri dan hexa terhidrasi.
Garam terbentuk dari ion cu2+ dan dua ion tidak3-, Memberikan kristalinitas karakteristik senyawa ionik (Ortorombik untuk garam anhidrida, rhomboédica untuk garam terhidrasi). Namun, tautannya memiliki karakter kovalen yang lebih besar.
Penggunaan/Aplikasi
Untuk warna nitrat tembaga yang menarik, garam ini menemukan digunakan sebagai aditif dalam keramik, pada permukaan logam, dalam beberapa kembang api dan juga di industri tekstil sebagai mordan.
Dapat melayani Anda: entalpiIni adalah sumber ionik yang baik untuk banyak reaksi, terutama yang mengkatalisasi reaksi organik. Ini juga menemukan kegunaan yang serupa dengan nitrat lain, baik sebagai fungisida, herbisida atau sebagai pengawet kayu.
Penggunaan utama dan paling baru lainnya adalah dalam sintesis katalis CuO, atau bahan dengan kualitas fotosensitif.
Ini juga digunakan sebagai reagen klasik di laboratorium pengajaran untuk menunjukkan reaksi di dalam sel volta.
Risiko
- Ini adalah agen yang sangat mengoksidasi, berbahaya bagi ekosistem laut, menjengkelkan, beracun dan korosif. Penting untuk menghindari semua kontak fisik secara langsung dengan reagen.
- Itu tidak mudah terbakar.
- Ini membusuk pada suhu tinggi melepaskan gas yang menjengkelkan, di antaranya2.
- Pada organisme manusia dapat menyebabkan kerusakan kronis pada sistem kardiovaskular dan saraf pusat.
- Dapat menyebabkan iritasi pada saluran pencernaan.
- Menjadi nitrat, di dalam tubuh itu menjadi nitrit. Nitrit meningkatkan kerusakan pada kadar oksigen dalam darah dan dalam sistem kardiovaskular.
Referensi
- Hari, r., & Underwood, a. Kimia analitik kuantitatif (Edisi kelima.). Pearson Prentice Hall, P-810.
- Mel Science. (2015-2017). Mel Science. Dipulihkan dari Mel Science: Melscience.com
- ResearchGate GmbH. (2008-2018). ResearchGate. Pulih dari risetgate: risetgate.bersih
- Laboratorium sains. Laboratorium sains. Dipulihkan dari Lab Sains: Sciencelab.com
- Whitten, Davis, Peck, & Stanley. (2008). Kimia (Edisi kedelapan.). P-321. Pembelajaran Cengage.
- Wikipedia. Wikipedia. Wikipedia pulih: di.Wikipedia.org

