Struktur nitrat timbal, sifat, memperoleh, menggunakan

- 707
- 40
- Mr. Darrell Streich
Dia memimpin nitrat o timbal nitrat (II) adalah senyawa anorganik yang dibentuk oleh elemen timbal (Pb), nitrogen (N) dan oksigen (O). Timbal ditemukan sebagai ion PB2+ Dan nitrogen dan oksigen membentuk ion nitrat3-.
Formula kimianya adalah PB (tidak3)2. Ini adalah padatan kristal putih yang sangat larut dalam air, di mana ia membentuk ion Pb2+ dan tidak3-. Ini juga dikenal sebagai plumbose nitrat karena timbal dalam keadaan oksidasi terendah.
 Nitrat timah solid. Domain Ondřej Mangl / Pub. Sumber: Wikimedia Commons.
Nitrat timah solid. Domain Ondřej Mangl / Pub. Sumber: Wikimedia Commons. Ini memiliki sifat pengoksidasi yang kuat, sehingga digunakan dalam aplikasi di mana karakteristik ini diperlukan, seperti dalam persiapan berbagai senyawa organik dan sebagai reagen laboratorium.
Di masa lalu itu banyak digunakan untuk menyiapkan warna -warna berbasis timbal, di mana ia juga bertindak sebagai pemecah warna di jaringan. Aplikasi ini ditinggalkan karena toksisitas timbal.
Ini telah digunakan dalam industri metalurgi dengan berbagai cara, dan baru -baru ini kegunaannya telah ditemukan terbentuk, bersama dengan senyawa lain, bahan dengan kapasitas penyerapan cahaya tinggi dan transformasi ini dalam listrik.
Namun, ini adalah zat yang berbahaya karena dapat mendukung generasi kebakaran. Ini juga beracun bagi manusia, hewan dan tumbuhan, sehingga tidak boleh dibuang di lingkungan.
[TOC]
Struktur
Itu adalah senyawa ionik yang dibentuk oleh kation Pb2+ dan dua anion no3-. Dalam anion nitrat oksigen disusun secara simetris di sekitar nitrogen dan ikatan rangkap alternatif dengan ini.
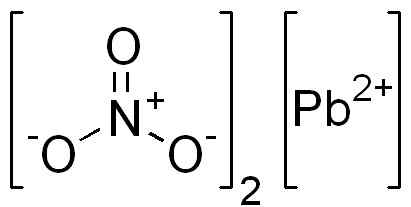 Struktur PB (Tidak3)2. Domain edgar181 / pub. Sumber: Wikimedia Commons.
Struktur PB (Tidak3)2. Domain edgar181 / pub. Sumber: Wikimedia Commons. 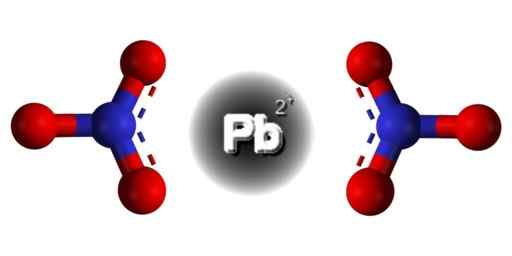 Struktur spasial PB (tidak3)2. Abu -abu = timbal; biru = nitrogen; Merah = oksigen. Claudio Pistilli/CC BYS-S (https: // CreativeCommons.Org/lisensi/by-sa/4.0). Sumber: Wikimedia Commons.
Struktur spasial PB (tidak3)2. Abu -abu = timbal; biru = nitrogen; Merah = oksigen. Claudio Pistilli/CC BYS-S (https: // CreativeCommons.Org/lisensi/by-sa/4.0). Sumber: Wikimedia Commons. Timbal dalam senyawa ini memiliki konfigurasi elektronik berikut:
[Xe] 4F14 5D10 6S2 6P0, di mana diamati bahwa ia telah kehilangan 2 elektron dari lapisan terakhir.
Dapat melayani Anda: apa elemen paling elektronegatif dan mengapa?Tata nama
- Memimpin nitrat
- Nitrat Timbal (II)
- Plumboso nitrat
- Memimpin dinitrate
Properti
Keadaan fisik
Padatan kristal putih atau tidak berwarna. Kristal kubik.
Berat molekul
331 g/mol
Titik lebur
470 ºC. Menurut beberapa sumber, ia membusuk pada suhu ini.
Kepadatan
4,53 g/cm3
Kelarutan
Sangat larut dalam air: 59,7 g/100 ml air pada suhu 25 ° C. Sedikit larut dalam etanol. Tidak larut dalam asam nitrat (hno3) terkonsentrasi.
ph
Larutan berair dengan 20% PB (tidak3)2 Ini memiliki pH 3.0-4.0.
Sifat kimia
Adalah agen pengoksidasi. Bereaksi dengan keras dengan bahan yang mudah terbakar dan peredam.
Itu bukan bahan bakar tetapi dapat mempercepat pembakaran bahan yang ada. Jika Anda memanaskan dekomposisinya memancarkan gas nitrogen oksida beracun:
2 PB (Tidak3)2 + Panas → 2 PBO + 4 Tidak2↑ + o2↑
Saat larut dalam air itu terionisasi:
PB (tidak3)2 + H2O → Pb2+ + 2 tidak3-
Memperoleh
Ini dapat disiapkan dengan bereaksi timbal logam, timbal monoksida (PBO) atau timbal karbonat3 Dengan asam nitrat. Lebih mudah menggunakan kelebihan asam untuk mencegah nitrat basa.
Pbo + 2 hno3 (terkonsentrasi) → PB (Tidak3)2↓+ h2SALAH SATU
Aplikasi
Di Organik
Kapasitas pengoksidasi memiliki aplikasi dalam persiapan berbagai senyawa.
Ini telah digunakan untuk mensintesis Calixarenos, yang merupakan senyawa organik yang molekulnya memiliki bentuk keranjang yang memungkinkan untuk menampung zat lain tergantung pada penggunaan yang akan diberikan padanya.
Itu berfungsi untuk mendapatkan isotiocianates (R-CS) mulai dari amina (R-NH2).
Ini digunakan pada skala industri untuk menyiapkan benzaldehida pengoksidasi benchilo chloride. Ini juga berfungsi sebagai katalis untuk esterifikasi senyawa organik, misalnya dalam mendapatkan poliester.
Dalam analisis kimia
Ini digunakan sebagai reagen dalam penentuan aluminium dan timbal dalam mineral dan batu.
Dalam warna serat tekstil
Beberapa pewarna krom memerlukan penggunaan PB (tidak3)2 untuk memperoleh. Misalnya, untuk mewarnai kapas kuning, ditutupi dengan timbal nitrat dan diobati dengan natrium sulfat untuk menghasilkan timbal sulfat.
Dapat melayani Anda: berat setaraKemudian larutan natrium dikromat encer diterapkan untuk membentuk kromat timbal (PBCRO4) Itu adalah pigmen kuning.
 Sebuah waktu yang lalu kain kuning diwarnai dengan pigmen yang titik awalnya adalah PB (tidak3)2. Ini tidak dilakukan dengan toksisitas timbal. Penulis: Perusahaan Produksi Animasi 3D. Sumber: Pixabay.
Sebuah waktu yang lalu kain kuning diwarnai dengan pigmen yang titik awalnya adalah PB (tidak3)2. Ini tidak dilakukan dengan toksisitas timbal. Penulis: Perusahaan Produksi Animasi 3D. Sumber: Pixabay. Namun, hari ini pigmen utama untuk toksisitas mereka telah dihentikan menggunakan.
Ini juga bertindak sebagai mordan untuk memperbaiki pewarna selama warna atau pencetakan jenis serat lainnya.
Di Medina Veterinary
Sebelumnya digunakan sebagai agen kaustik dalam perawatan chancros atau gangrenas pada kuda.
Di industri logam
Nitrat timbal digunakan dalam pemurnian timbal elektrolitik, sebagai agen untuk mendukung pengapungan dalam penghapusan titanium lempung tertentu, memungkinkan untuk memulihkan logam mulia dari larutan sianida dan digunakan dalam elektroda PBO2 di anoda nikel.
Dalam sel surya
Telah digunakan dalam bentuk larutan air untuk membuat sel surya berdasarkan perovskita, mineral titanium oksida.
Bahan yang disintesis adalah organometalik atau pervskita timah iodida yang telah menarik perhatian para peneliti, karena memiliki kapasitas penyerapan cahaya yang tinggi dan panjang difusi yang besar dari pembawa beban.
Karakteristik ini menjadikannya kandidat yang sangat baik untuk perangkat fotovoltaik, yaitu, mereka mengubah cahaya menjadi arus listrik.
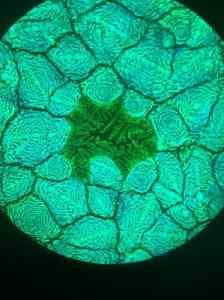 Mikrofotografi struktur unavskita timbal halida yang diambil dengan mikroskop fluoresensi. Furava/cc by (https: // createveCommons.Org/lisensi/oleh/4.0). Sumber: Wikimedia Commons.
Mikrofotografi struktur unavskita timbal halida yang diambil dengan mikroskop fluoresensi. Furava/cc by (https: // createveCommons.Org/lisensi/oleh/4.0). Sumber: Wikimedia Commons. Aplikasi lain
Dia (pbno3)2 Itu juga telah digunakan:
- Dalam pembuatan kecocokan, bahan peledak tertentu dan bahan piroteknik,
- Dalam fotografi sebagai agen yang peka untuk menutupi kertas dalam fototermografi,
- Dalam industri tekstil untuk meningkatkan rayon dan menstabilkan nilon,
- Dalam penghapusan tikus.
 Nitrat timah telah digunakan untuk memproduksi kembang api atau bahan kembang api. Penulis: Goos gratis. Sumber: Pixabay.
Nitrat timah telah digunakan untuk memproduksi kembang api atau bahan kembang api. Penulis: Goos gratis. Sumber: Pixabay. Risiko
Api dan ledakan
Meskipun bukan senyawa bahan bakar, jika terpapar api atau panas, ia dapat meledak, menghasilkan nitrogen oksida beracun.
Menjadi agen pengoksidasi yang kuat ada bahaya bahwa api dihasilkan jika bersentuhan dengan bahan organik.
Untuk kesehatan
Menghasilkan iritasi mata, pernapasan dan saluran pencernaan. Itu beracun dengan inhalasi dan konsumsi. Gejala keracunan yang paling umum oleh senyawa ini adalah gastrointestinal, kolik, sembelit dan kelemahan yang dapat menjadi kelumpuhan beberapa otot, antara lain, antara lain.
Konsumsi juga dapat menyebabkan rasa sakit, kram, depresi, koma dan kematian.
Untuk lingkungan alam
Ini beracun bagi organisme akuatik dan tanah, selain itu kerusakan mereka gigih dan bioakumula pada makhluk hidup, oleh karena itu dianggap sebagai polutan berbahaya dan tidak boleh dibuang ke lingkungan.
Jika secara tidak sengaja tumpah dalam air, harus dinetralkan dengan kalsium oksida (CAO), kalsium karbonat (CACO3) atau natrium bikarbonat (nahco3).
Telah dikonfirmasi bahwa itu adalah karsinogen untuk hewan dan mungkin bagi manusia.
Referensi
- ATAU.S. Perpustakaan Kedokteran Nasional. (2019). Timah (ii) nitrat. Pulih dari pubchem.NCBI.Nlm.Nih.Pemerintah.
- Hsih, t.DAN. et al. (2015). Sel surya posvskit yang efisien dibuat menggunakan prekursor nitrat timbal. Chem Commun (Ubah). 2015 Sep 4; 51 (68): 13294-7. NCBI pulih.Nlm.Nih.Pemerintah.
- Vratny, f. dan gugliotta, f. (1963). Dekomposisi Timbal Nitrat Timbal. J. Inorg. Nucl. Chem., 1963, Vol. 25, hlm. 1129-1132. Pulih dari scientedirect.com.
- Chakraborty, J.N. (2014). Mewarnai dengan warna mineral. Dalam dana dan praktik dalam warna tekstil. Pulih dari scientedirect.com.
- Kumari, h. dan Atwood, J. (2017). Calixarenes di Solid State. Sebagai referensi modulasi dalam kimia, ilmu molekuler dan rekayasa kimia. Pulih dari scientedirect.com.
- Jeffery, hlm.G. dan Hutchison, D. (1981). Aluminium. Dalam Metode Kimia Analisis Batu (Edisi Ketiga). Pulih dari scientedirect.com
- Sandler, s.R. dan karo, w. (1992). Sianat, isocyanate, thiocyanate, dan isothiocyanate. Dalam buku sumber persiapan laboratorium organik canggih. Pulih dari scientedirect.com.
- Smith, hlm.W.G. et al. (1969). Senyawa halogen aromatik. Dalam kimia aromatik. Pulih dari scientedirect.com.
- Kapas, f. Albert dan Wilkinson, Geoffrey. (1980). Kimia anorganik canggih. Edisi keempat. John Wiley & Sons.
- Timah, d.R. (Editor) (2003). Buku Pegangan Kimia dan Fisika CRC. 85th CRC Press.
- Wikimedia Foundation (2020). Timah (ii) nitrat. Diterima dari.Wikipedia.org.
- Shinde, d.V. et al. (2017). Peningkatan efisien dan stabilitas sel surya perovskite organometalllic berbasis timbal-nitrat. ACS Appl. Mater. Interfaces 2017, 9, 14023-14030. Pulih dari pub.ACS.org.
- « Fenol atau sifat senyawa fenolik, jenis, aplikasi
- Struktur timbal asetat, sifat, memperoleh, menggunakan »

