Struktur nitium nitrit (nano2), sifat, penggunaan, risiko

- 2294
- 674
- Herbert Fritsch
Dia Sodium nitrite Ini adalah padatan anorganik kristal yang dibentuk oleh ion natrium+ dan ion nitrit no2-. Formula kimianya adalah nano2. Ini adalah padatan kristal putih yang cenderung menyerap air dari lingkungan, yaitu, higroskopis.
Di hadapan udara secara perlahan mengoksidasi nitrat nitrat3. Ini memiliki sifat pengoksidasi (teroksidasi senyawa lain) dan juga peredam (dioksidasi oleh senyawa lain).
 Nano Sodium Nitrite2. Aleksander Sobolewski via Wikimedia Commons [CC BY-SA 4.0 (https: // createveCommons.Org/lisensi/by-sa/4.0)]. Sumber: Wikimedia Commons.
Nano Sodium Nitrite2. Aleksander Sobolewski via Wikimedia Commons [CC BY-SA 4.0 (https: // createveCommons.Org/lisensi/by-sa/4.0)]. Sumber: Wikimedia Commons. Ini hadir dalam organisme manusia secara alami dan digunakan sebagai pengawet daging yang disembuhkan dan ikan asap karena menghindari pertumbuhan mikroorganisme berbahaya.
Ini memiliki penggunaan penting dalam pengobatan urgensi keracunan sianida, karena efek toksik dan mematikan dari senyawa tersebut berkurang. Namun, itu harus dikelola dengan sangat hati -hati dan tidak berhasil dalam semua kasus.
Telah ditemukan bahwa itu dapat mencegah infeksi mata yang disebabkan oleh kontaminasi lensa kontak oleh mikroorganisme. Beberapa penelitian menunjukkan bahwa konsumsi mereka dengan makanan dapat menyebabkan kanker, tetapi diperkirakan ini dapat dihindari dengan makan vitamin C dengan makanan seperti itu.
[TOC]
Struktur
Sodium nitrit dibentuk oleh na kation natrium+ Dan anion nitrit2-.
Dalam anion nitrit no2- Nitrogen memiliki valensi +3 dan oksigen -2, karena alasan ini anion memiliki beban negatif global tunggal.
Anion nitrit no2- Ini memiliki struktur sudut, yaitu, ikatan nitrogen (N) dengan atom oksigen (O) membentuk sudut.
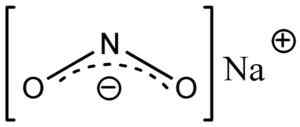 Struktur nitium nitium nano2, di mana Anda dapat melihat bentuk sudut anion nitrit tidak2-. Eschenmoser [domain publik]. Sumber: Wikimedia Commons.
Struktur nitium nitium nano2, di mana Anda dapat melihat bentuk sudut anion nitrit tidak2-. Eschenmoser [domain publik]. Sumber: Wikimedia Commons. Tata nama
- Sodium nitrite
- Sodium nitrite
- Garam natrium asam nitrat.
Properti
Keadaan fisik
Padatan kristal putih kekuningan. Kristal Ortorombik.
Berat molekul
68.995 g/mol
Titik lebur
271 ºC
Titik didih
Jangan mendidih. Itu terurai di atas 320 ºC
Itu dapat melayani Anda: magnesium hidrida: struktur, sifat dan penggunaanKepadatan
2.17 g/cm3 pada 20 ºC
Kelarutan
Air larut: 84,8 g/100 g air pada 25 ºC. Sedikit larut dalam etanol. Cukup larut dalam metanol. Hampir tidak larut dalam dialyl eter.
ph
Solusi berairnya adalah basa, pH sekitar 9. Ini karena asam nitrat adalah asam lemah yang cenderung tidak terpisah, jadi ion tidak2- Cobalah untuk mengambil proton h+ Air untuk membentuk hno2, yang mengarah pada pembentukan ion OH- Mereka menghasilkan alkalinitas.
TIDAK2- + H2O → hno2 + Oh-
Properti lainnya
Nano nitium nitrit2 Di hadapan udara secara perlahan mengoksidasi nitrat nitrat3. Ini adalah padatan higroskopis, karena menyerap air dari lingkungan.
Ini memiliki sifat pengoksidasi (dapat mengoksidasi senyawa lain) dan juga reduksi (dapat dioksidasi dengan senyawa lain).
Jika Anda bersentuhan dengan bahan seperti kayu, kertas atau tekstil, Anda dapat membuatnya masuk ke dalam pembakaran berbahaya.
Dengan asam dekomposisinya terjadi, menghasilkan campuran gas beracun nitrogen oksida (NOX).
Memperoleh
Itu dapat diperoleh dengan memanaskan nano natrium nitrat3 Dengan pb lead:
Kakak3 + PB → Nano2 + Pbo
Kehadiran dalam organisme
Anion nitrit secara alami hadir dalam darah dan jaringan, karena dibentuk sebagai konsekuensi dari oksidasi non -.
Aplikasi
Di industri makanan
Ini digunakan untuk adobar daging karena bertindak sebagai zat retensi warna dan rasa, dan sebagai pengawet karena mengendalikan pertumbuhan mikroorganisme, menghindari khususnya pengembangan perkembangan dari Clostridium botulinum Menyebabkan penyakit botulisme.
Sodium nitrit pada daging bereaksi dengan hemoglobin sel darah merah atau sel darah merah makanan ini. Ini juga digunakan dalam ikan asap sembuh.
 Ikan asap. Penulis: Reinhard Thrainer. Sumber: Pixabay.
Ikan asap. Penulis: Reinhard Thrainer. Sumber: Pixabay. Sebagai perawatan darurat dalam keracunan sianida
Nitium nitrit digunakan untuk pengobatan keracunan sianida akut. Ini adalah penangkal untuk masalah serius ini.
Dapat melayani Anda: asetonitril (C2H3N)Tindakannya disebabkan oleh fakta bahwa ia mendukung pembentukan methemoglobin (sejenis hemoglobin) dalam darah, yang menangkap ion sianida dan tidak melepaskannya, dan dengan demikian mencegah mereka dilepaskan dalam sel, membuat mereka kurang beracun beracun.
Dalam kasus keracunan sianida, natrium nitrit diaplikasikan secara intravena, membutuhkan waktu sekitar 12 menit untuk menghasilkan methemoglobin. Terlepas dari penundaan ini, ia juga menawarkan perlindungan untuk efek vasodilatornya.
 Pengobatan intravena. Michaelberry at English Wikipedia [CC by 3.0 (https: // createveCommons.Org/lisensi/oleh/3.0)]. Sumber: Wikimedia Commons.
Pengobatan intravena. Michaelberry at English Wikipedia [CC by 3.0 (https: // createveCommons.Org/lisensi/oleh/3.0)]. Sumber: Wikimedia Commons. Untuk pelebaran pembuluh darah
Ini berfungsi untuk mengobati hipertensi arteri paru karena bertindak dengan menunda pembuluh darah sehingga menurunkan tekanan darah. Diperkirakan bahwa efek ini disebabkan oleh fakta bahwa itu diubah menjadi nitrat oksida bukan yang bertindak merilekskan otot lunak.
Namun, penyebab efektivitasnya masih diteliti.
Melawan beberapa parasit
Peneliti tertentu menemukan bahwa natrium nitrit menghambat pertumbuhan dan multiplikasi parasit usus Blastocystis hominis Bahkan jika ini resisten terhadap obat lain.
Ditemukan bahwa nano2 Ini menghasilkan kematian parasit ini oleh apoptosis, yang merupakan semacam bunuh diri sel parasit. Sodium nitrit menyebabkan sel usus tidak menghasilkan, yang tampaknya penting dalam proses ini.
Untuk menghindari kerusakan organ
Menurut beberapa penelitian, nitrit adalah penghambat kuat kerusakan jantung dan hati dalam proses iskemia (penurunan irigasi darah di bagian tubuh). Dipercayai bahwa ini karena ini adalah cadangan biologis dari no.
Disimpulkan bahwa itu dapat digunakan untuk mencegah kerusakan pada organ setelah memulihkan aliran darah yang telah terganggu oleh serangan jantung, intervensi bedah perut yang tinggi atau transplantasi beberapa organ.
Untuk menghindari infeksi untuk penggunaan lensa kontak
Telah ditemukan bahwa nano2 mencegah pembentukan film mikroorganisme patogen Staphylococcus aureus Dan Pseudomonas aeruginosa Tentang lensa kontak.
Dapat melayani Anda: reduksi (kimia) Lensa kontak dapat terkontaminasi dengan bakteri atau jamur. Hubungi Lensa Fotografi pada 7 Januari 2006. Sumber: Fotografi oleh BPW. Sumber: Wikimedia Commons.
Lensa kontak dapat terkontaminasi dengan bakteri atau jamur. Hubungi Lensa Fotografi pada 7 Januari 2006. Sumber: Fotografi oleh BPW. Sumber: Wikimedia Commons. Dalam beberapa kegunaan
Sodium nitrit digunakan untuk memproduksi pewarnaan, obat -obatan dan berbagai senyawa organik.
Ini juga berfungsi sebagai penghambat korosi pada banyak lemak.
Risiko atau ketidaknyamanan
Salah satu masalah menggunakan nitium nitrit untuk keracunan sianida adalah bahwa hal itu menyebabkan gangguan kardiovaskular yang serius pada anak -anak.
Tidak dianjurkan untuk korban kebakaran di mana paparan simultan sianida dan karbon monoksida (CO) terjadi (CO). CO mengurangi kemampuan darah untuk mengangkut oksigen, sehingga pemberian nano2 akan memperburuk kondisi oksigen kecil dalam darah pasien.
Sodium nitrit inhalasi menjengkelkan dan beracun, dapat merusak sistem kardiovaskular dan sistem saraf pusat. Selain itu, ia berbahaya bagi lingkungan.
Sodium nitrit yang dicerna dengan makanan bisa berbahaya. Nitrit, setelah mencapai lambung, bereaksi dengan senyawa tertentu yang membentuk nitrosamin, yang dapat menghasilkan kanker.
Reaksi ini dapat dihindari dengan adanya vitamin C.
Menurut sumber -sumber tertentu yang dikonsultasikan, risiko mengonsumsi nitrit dengan daging atau ikan yang disembuhkan minimal karena nitrit secara alami hadir dalam air liur.
Sumber menunjukkan bahwa risiko ini juga minimal dibandingkan dengan manfaat besar dari mengonsumsi makanan yang bebas dari mikroorganisme berbahaya.
Referensi
- Bhattacharya, r. dan flora, s.J.S. (2015). Toksisitas sianida dan perawatannya. Dalam Buku Pegangan Toksikologi Agen Peperangan Kimia (Edisi Kedua). Pulih dari scientedirect.com.
- ATAU.S. Perpustakaan Kedokteran Nasional. (2019). Sodium nitrite. Pulih dari: pubchem.NCBI.Nlm.Nih.Pemerintah.
- Kim, d.J. et al. (2017). Kemanjuran antibiofilm nitrat oksida pada lensa kontak lunak. BMC Ophthalmol 17, 206 (2017). Diperoleh dari bmcophthalmol.Biomedcentral.com.
- Ramis-Ramos, g. (2003). Antioksidan. Antioksidan sintetis. Dalam Encyclopedia of Food Sciences and Nutrition (Edisi Kedua). Pulih dari scientedirect.
- Barozzi Seabra, a. dan Durán, n. (2017). Donor oksida nitrat untuk mengobati penyakit yang diabaikan. Pada donor oksida nitrat. Pulih dari scientedirect.com.
- Duranski, m.R. et al. (2005). Efek sitoprotektif nitrit selama reperfusi iskemia in vivo dari jantung dan hati. J Clin Invest 2005; 115 (5): 1232-1240. NCBI pulih.Nlm.Nih.Pemerintah.
- Kapas, f. Albert dan Wilkinson, Geoffrey. (1980). Kimia anorganik canggih. Edisi keempat. John Wiley & Sons.

