Serangan Nukleofilik Nukleofilik, Jenis, Contoh, Nukleofilisitas
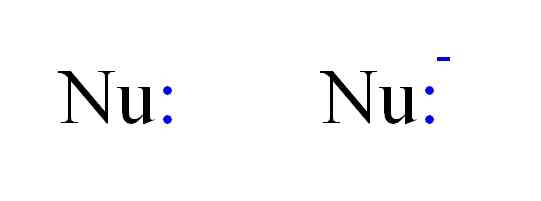
- 2596
- 690
- Jessie Harvey
A nukleofil Semua atom, ion atau molekul yang berupaya menyumbangkan pasangan elektron ke zat dengan beban atau daerah positif. Kata itu berarti 'cinta untuk inti'. Ketika atom atau daerah molekuler buruk dalam elektron, ia mengalami kekuatan ketertarikan yang lebih besar oleh inti atom; Dan tepatnya, atraksi ini menarik nukleofil.
Oleh karena itu, karena tanda -tanda yang berlawanan, biaya tertarik, nukleofil harus merupakan spesies negatif; atau setidaknya, memiliki daerah yang sangat negatif karena konsentrasi elektron lokal atau tersebar.
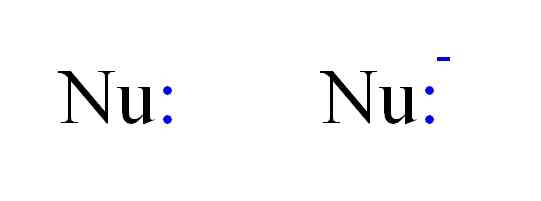 Dua jenis nukleofil paling sering dalam kimia. Sumber: Gabriel Bolívar.
Dua jenis nukleofil paling sering dalam kimia. Sumber: Gabriel Bolívar. Dengan demikian, nukleofil dapat diwakili oleh huruf Nu, seperti pada gambar di atas. Titik ganda berwarna biru sesuai dengan beberapa elektron, yang menyumbang ke elektrofil; Ini adalah, atom atau molekul elektron yang buruk. Perhatikan bahwa nukleofil bisa netral atau anionik, namun keduanya menyumbangkan pasangan elektron.
Serangan nukleofil terhadap elektrofil adalah landasan reaksi yang tak terhitung jumlahnya dan mekanisme organik. Contoh nukleofil adalah hidroksil anion, oh-, itu juga berperilaku sebagai basis. Namun, nukleofilis tidak boleh dikacaukan dengan kebasaan zat.
[TOC]
Serangan nukleofilik
Nukleofil terlihat. Persamaan kimia berikut mewakili serangan nukleofil:
Rusa kutub: + R-LG → R-NU + LG:
Nu Nu: Menyumbangkan sepasang elektron A R, yang terkait dengan kelompok LG elektronegatif. Dengan melakukan itu, tautan R-LG rusak, LG's Emigra:, dan tautan R-NU yang baru terbentuk. Ini adalah dasar bagi banyak reaksi organik.
Akan terlihat di bagian selanjutnya bahwa nukleofil bahkan dapat menjadi cincin aromatik, yang kepadatan elektroniknya tersebar di tengahnya. Demikian juga, nukleofil dapat menjadi ikatan sigma, yang berarti bahwa elektron dari yang sama beremigrasi atau melompat ke inti di dekatnya.
Dapat melayani Anda: Kalium Chromate (K2CRO4)Jenis Nukleofil
Ada beberapa jenis nukleofil, tetapi mayor besar.
Spesies dengan pasangan elektron gratis
Saat berbicara tentang spesies dengan pasangan elektron bebas, kami merujuk pada anion, atau molekul dengan atom elektronegatif, seperti oksigen, nitrogen dan belerang. Di bagian contoh banyak nukleofil jenis ini akan terlihat, terlepas dari anion oh- sudah disebutkan.
Tautan ganda
Nukleofil dapat memiliki ikatan rangkap, yang bertanggung jawab atas serangan nukleofilik. Namun, mereka harus menjadi ikatan rangkap dengan kepadatan elektronik yang cukup besar, jadi tidak ada molekul yang memilikinya akan dianggap sebagai nukleofil yang kuat; Artinya, tidak akan memiliki nukleofilisitas tinggi.
Misalnya, pertimbangkan cincin benzena dalam reaksi alkilasi (reaksi Friedel-Crafts berikut):
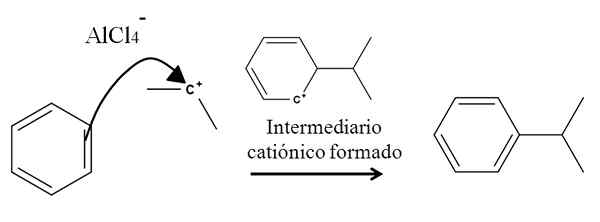 Alkilasi benzena dalam substitusi elektrofilik aromatik. Sumber: Gabriel Bolívar.
Alkilasi benzena dalam substitusi elektrofilik aromatik. Sumber: Gabriel Bolívar. Adanya campuran alcl3-(Ch3)2CHCL berasal dari karbokasi isopropil. Beban dan ketidakstabilan positifnya sangat menarik elektron dari salah satu ikatan rangkap benzena, yang menyerang karbokasi, seperti yang diwakili oleh panah.
Dalam prosesnya, antarmilier kationik dan aromatik singkat terbentuk, yang akhirnya diubah menjadi produk yang tepat.
Seperti halnya benzena, zat lain dengan ikatan rangkap dapat bertindak sebagai nukleofil, asalkan kondisi reaksi adalah yang paling tepat. Demikian juga, harus ada atom yang terletak di dekat ikatan rangkap yang menyumbangkan kepadatan elektronik, sehingga mereka "mengisi ulang" elektron.
Tautan sigmas
Obligasi Sigma karena itu bukan nukleofil; Tetapi bisa berperilaku seperti itu sekali reaksi dimulai dan mekanismenya dimulai. Pertimbangkan contoh berikut:
Itu dapat melayani Anda: garam linding: apa itu, nomenklatur, properti, contoh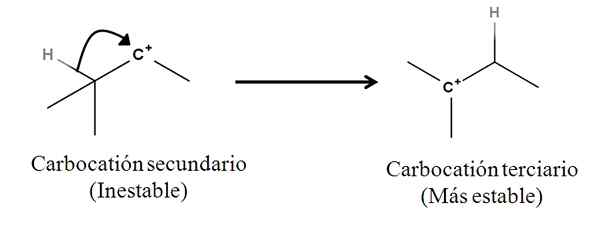 Konversi karbokasi sekunder ke tersier dengan migrasi dari anion hidrida. Sumber: Gabriel Bolívar.
Konversi karbokasi sekunder ke tersier dengan migrasi dari anion hidrida. Sumber: Gabriel Bolívar. Ikatan Sigma C-H yang berdekatan dengan karbokasi bergerak ke arahnya berperilaku seperti nukleofil (lihat pergerakan panah melengkung). Dalam hal ini, hasilnya adalah anion h bergerak- untuk karbon tetangga, tetapi begitu cepat sehingga ikatan sigma dan sepasang elektronnya sebagai agen nukleofilik dari mekanisme ini dipertimbangkan.
Contoh nukleofil
Bagian ini akan menyebutkan beberapa contoh jenis nukleofil pertama, yang sangat berlimpah dan penting dalam kimia organik dan anorganik.
Halogenuros
Halogenuros (f-, Cl-, Br- dan saya-) Mereka adalah nukleofil. Harus menyumbangkan salah satu dari empat pasang elektron valensi mereka. Tergantung pada kecepatan salah satu halogenuros ini menyerang elektrofi, akan memiliki nukleofilisitas yang lebih besar atau lebih kecil.
Secara umum, i- Lebih baik nukleofil daripada f- dan halogenuros lainnya, karena lebih mudah untuk membentuk tautan kovalen karena lebih terpolarisasi; Yaitu, lebih besar dan dengan keuletan yang lebih sedikit untuk melepaskan sepasang elektronnya.
Molekul atom elektronegatif
 Molekul air
Molekul air Air, hah, adalah nukleofil, karena atom oksigen memiliki kepadatan negatif yang tinggi dan pasangan elektron bebas untuk menyumbang dan membentuk ikatan kovalen. Juga, alkohol, ROH, adalah nukleofil, untuk alasan yang sama seperti air.
Molekul nitrogen kecil seperti amonia, NH3, Mereka juga cenderung nukleofil. Ini karena nitrogen dapat menyumbangkan sepasang elektron yang soliter. Demikian pula, amina, rnh2, Mereka juga nukleofil.
Dan selain molekul kecil dengan oksigen atau nitrogen, sulfur juga dihitung sebagai nukleofil. Ini adalah kasus hidrogen sulfida, h2S, dan thioles, rsh.
Sulfur lebih baik nukleofil daripada oksigen dan nitrogen karena kurang "melekat" pada sepasang elektronnya, jadi lebih mudah untuk menyumbangkannya. Untuk fakta ini juga harus ditambahkan bahwa atomnya lebih tebal, yaitu lebih terpolarisasi, dan karenanya mampu membentuk ikatan kovalen dengan lebih sedikit kesulitan.
Itu dapat melayani Anda: Metode Mohr: Fundamental, Reaksi, Prosedur, PenggunaanAnion
Anion teroksigenasi, nitrogen, sulfurisasi, dan secara umum beberapa di antaranya adalah nukleofil yang kuat. Ini karena mereka sekarang memiliki beban negatif yang semakin mengintensifkan keberadaan pasangan elektron yang akan mereka sumbangkan.
Pertimbangkan misalnya anion berikut ditempatkan dalam penurunan urutan nukleofilisitas:
: Ch3- >: NH2- >: Oh- >: F-
Karboanion ch3- Ini adalah nukleofil terkuat karena atom karbon tidak menstabilkan beban negatif, yang elektronnya "putus asa" dengan nukleus di dekatnya. Ini tidak terjadi dengan Amiduro, NH2-, atom nitrogen yang lebih baik menstabilkan beban negatif dan menghasilkan sepasang elektron lebih mudah daripada OH- atau f-.
Nukleofilisitas
Nukleofilisitas mendefinisikan seberapa kuat karakter nukleofil dari suatu spesies. Ini tergantung pada banyak faktor, tetapi yang paling penting adalah hambatan sterik selama serangan nukleofilik dan aksi pelarut.
Semakin kecil nukleofil, semakin cepat dan efektif akan menjadi serangan elektrofil Anda. Juga, seberapa rendah interaksi antara pelarut dan nukleofil. Karena itu, menurut ini, i- memiliki nukleofilisitas yang lebih besar dari f-.
Referensi
- Morrison, r. T. dan boyd, r, n. (1987). Kimia organik. Edisi ke -5. Editorial Addison-Wesley Inter-American.
- Carey f. (2008). Kimia organik. (Edisi Keenam). MC Graw Hill.
- Graham Solomons t.W., Craig b. Fryhle. (2011). Kimia organik. (Edisi ke -10.). Wiley Plus.
- James Ashenhurst. (2020). Tiga kelas nukleofil. Dipulihkan dari: Masterorganicchemistry.com
- Profesor Patricia Shaley. (2012). Nukleofil dan Elektrofil. Universitas Illinois. Pulih dari: butana.Chem.UIUC.Edu
- Wikipedia. (2020). Nukleofil. Diperoleh dari: di.Wikipedia.org
- Helmestine, Anne Marie, PH.D. (11 Februari 2020). Definisi Nukleofil dalam Kimia. Pulih dari: thinkco.com
- Rachael Curtis. (5 Juni 2019). Nukleofil. Libretteks Kimia. Pulih dari: chem.Librettexts.org

