Karakteristik oxihemoglobin, struktur dan kurva persimpangan
- 4724
- 1270
- Jessie Harvey
SALAH SATUXihemoglobin Itu adalah nama yang diterima hemoglobin saat bergabung dengan oksigen. Hemoglobin adalah protein yang ada di dalam sel darah merah dan yang fungsi utamanya adalah untuk mengangkut oksigen dari paru -paru ke jaringan.
Makhluk hidup pertama adalah uniseluler dan hidup dalam suasana cair dari mana mereka dipelihara dan yang mereka hilangkan limbah mereka, serta beberapa organisme yang saat ini ada. Dalam kondisi ini, proses ini dicapai dengan mekanisme diseminasi sederhana, karena dinding sel bersentuhan dengan media yang memasoknya.
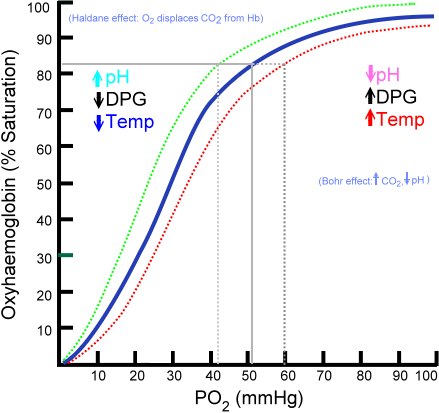
 Kurva Disosiasi Oxihemoglobin (Sumber: Ratznium di Bahasa Inggris Versi Wikipedialat diunggah oleh Aaronsharpe di In In.Wikipedia. [Domain Publik] Melalui Wikimedia Commons)
Kurva Disosiasi Oxihemoglobin (Sumber: Ratznium di Bahasa Inggris Versi Wikipedialat diunggah oleh Aaronsharpe di In In.Wikipedia. [Domain Publik] Melalui Wikimedia Commons) Perkembangan organisme pluriseluler yang semakin kompleks menyiratkan bahwa sel -sel internal sangat jauh dari lingkungan, sehingga mekanisme penyebaran sebagai satu -satunya sumber pasokan menjadi tidak mencukupi.
Dengan demikian, sistem khusus dikembangkan untuk mendapatkan nutrisi dan gas seperti sistem pencernaan dan sistem pernapasan, serta mekanisme transportasi untuk membawa nutrisi dan gas ini ke sel: sistem kardiovaskular.
Untuk menghasilkan energi dalam bentuk molekul ATP, sel membutuhkan oksigen. Mengingat fakta bahwa ATP tidak dapat disimpan, itu harus terus disintesis, yang berarti permintaan permanen untuk oksigen oleh sel.
Hemoglobin muncul, secara evolusioner, sebagai pengangkut gas yang "memecahkan" masalah transportasi oksigen dari lingkungan ke sel.
[TOC]
Karakteristik dan Struktur
Untuk berbicara tentang karakteristik dan struktur oxyhemoglobin, perlu merujuk pada hemoglobin, karena oxyhemoglobin tidak lebih dari hemoglobin oksigen. Oleh karena itu, mulai sekarang, karakteristik sendi molekul di hadapan atau tidak dari gas yang dimaksud akan dijelaskan.
Untuk apa hemoglobin?
Hemoglobin diperlukan untuk mengangkut oksigen ke jaringan dalam jumlah dan kecepatan yang mereka pantas, mengingat fakta bahwa oksigen memiliki sedikit kelarutan darah sehingga transportasi difusinya tidak cukup untuk memasok kebutuhan jaringan.
Dapat melayani Anda: bukti evolusi makhluk hidupBagaimana molekul hemoglobin?
Hemoglobin adalah protein tetramerik (yang memiliki empat subunit), memiliki bentuk bola dan massa molekul 64 kDa.
Empat subunitnya merupakan unit fungsional tunggal, di mana masing -masing secara timbal balik mempengaruhi yang lain. Setiap subunit terdiri dari rantai polipeptida, globin, dan kelompok prostetik, kelompok hemo atau "hem", yang bertindak sebagai kofaktor dan tidak dibentuk oleh asam amino; Artinya, ini bukan sifat protein.
Globin dalam dua cara: Alpha Globin dan Beta Globin. Tetramer hemoglobin terdiri dari sepasang rantai globin alfa (141 asam amino) dan beberapa rantai beta globin (146 asam amino).
Masing -masing dari empat rantai polipeptida terkait dengan kelompok hemo, yang memiliki atom besi dalam keadaan besi (Fe2+) di tengah.
Bagaimana kelompok hemo?
Kelompok hemo adalah cincin porfirin yang dibentuk oleh empat cincin pirolik (senyawa aromatik heterosiklik dengan formula C4H5N) yang disatukan oleh jembatan metil. Besi dalam keadaan besi yang ditemukan di pusat tunduk pada struktur melalui hubungan nitrogen terkoordinasi.
Setiap kelompok hemo dapat bergabung dengan molekul oksigen, sehingga setiap molekul hemoglobin hanya dapat bergabung dengan 4 molekul gas.
Tubuh manusia mengandung sekitar 2,5 x 1013 eritrosit, yang merupakan sel darah yang menghasilkan dan mengangkut hemoglobin. Setiap eritrosit memiliki sekitar 280 juta molekul hemoglobin dan kemudian dapat mengangkut lebih dari 1000 juta molekul oksigen.
Dapat melayani Anda: Proses Hominisasi: Karakteristik dan FaseBagaimana oxyhemoglobin terbentuk?
Oxihemoglobin terbentuk setelah penyatuan atom oksigen untuk setiap atom besi besi yang menemukan pada setiap kelompok hemo dari molekul hemoglobin.
Istilah oxihemoglobin kemudian mengacu pada hemoglobin teroksigenasi dan tidak teroksidasi secara kimia, karena tidak kehilangan elektron ketika dikombinasikan dengan oksigen dan zat besi tetap dalam keadaan besi.
Oksigenasi menghasilkan perubahan dalam struktur kuaterner molekul, yaitu perubahan konformasi yang dapat ditularkan dari rantai globin ke hemo dan sebaliknya kelompok.
Berapa jumlah maksimum oksigen yang dapat memuat hemoglobin?
Hemoglobin dapat, paling banyak, bergabung dengan empat molekul oksigen dalam strukturnya. Jika volume molar gas ideal adalah 22.4 l/mol, satu mol hemoglobin (64.500g) akan bergabung dengan 89.6 liter oksigen (4 mol O2 x 22.4 l/mol).
Jadi, setiap gram hemoglobin harus bergabung 1.39 mL O2 menjadi 100% jenuh (89.6L/64500G X (1000ml/L)).
Dalam praktiknya, tes darah menunjukkan hasil yang sedikit lebih rendah, karena ada sejumlah kecil methemoglobin (teroksidasi hemoglobin) dan carboxyhemoglobin (hemoglobin + karbon monoksida (CO)) yang tidak dapat bergabung dengan oksigen.
Mempertimbangkan ini, aturan "Hüfner" menetapkan bahwa, dalam darah, 1g hemoglobin memiliki kapasitas maksimum untuk menyatukan oksigen 1.34ml.
Kurva pengikat oxyhemoglobin
Jumlah molekul oksigen yang dapat digabungkan dengan molekul hemoglobin tergantung pada tekanan oksigen parsial atau PO2. Dengan tidak adanya oksigen, hemoglobin dideoksigenasi, tetapi ketika PO2 meningkat, jumlah oksigen yang berikatan dengan hemoglobin meningkat.
Proses pengikatan oksigen untuk hemoglobin tergantung pada tekanan oksigen parsial. Saat grafik, hasilnya disebut "kurva oxihemoglobin" dan memiliki bentuk karakteristik 'S' atau sigmoid.
Dapat melayani Anda: TaksismaBergantung pada PO2, hemoglobin akan berada dalam kapasitas yang lebih rendah atau lebih besar untuk "melepaskan" atau "mengirimkan" oksigen yang diangkutnya, serta memuat dengan ini.
Misalnya, di wilayah antara 10 dan 60 mmHg tekanan Anda mendapatkan bagian dengan lebih banyak tertunda kurva. Dalam kondisi ini hemoglobin dapat dengan mudah menghasilkan sejumlah besar O2. Ini adalah kondisi yang dicapai dalam jaringan.
Ketika PO2 antara 90 dan 100 mmHg (12 hingga 13 kPa), hemoglobin hampir 100% jenuh dengan O2; Dan ketika PO2 arteri adalah 60 mmHg (8 kPa) saturasi dengan O2 masih setinggi 90%.
Di paru -paru ini adalah kondisi yang mendominasi (tekanan antara 60 dan 100 mmHg), dan inilah yang memungkinkan molekul hemoglobin yang ada dalam eritrosit yang akan dimuat dengan oksigen.
Bentuk sigmoid ini yang menarik kurva oxihemoglobin memastikan bahwa protein ini berperilaku sebagai pengisi daya yang sangat baik pada tingkat paru, konveyor yang sangat efisien dalam tekanan darah dan donor O2 yang sangat baik di jaringan, sebanding dengan laju metabolisme lokal, yaitu, yaitu, yaitu, yaitu, yaitu, yaitu, yaitu, yaitu, yaitu, yaitu, yaitu, yaitu, yaitu, yaitu, yaitu, yaitu, yaitu, yaitu, yaitu, yaitu, yaitu, yaitu, sebanding dengan laju metabolisme lokal, untuk meminta.
Referensi
- Rubah, s. yo. (2006). Fisiologi Manusia Edisi ke -9 (hal. 501-502). McGraw-Hill Press, New York, AS.
- Murray, r. K., Granner, d. K., Mayes, p. KE., & Rodwell, v. W. (2014). Biokimia Illustrated Harper. McGraw-Hill.
- Rawn, J. D. (1998). Biokimia (1989). Burlington, North Carolina: Penerbit Neil Patterson (C) N. Lalioti, cp raptopoulou, a. Terzis, a. Panagiotopoulos, SP Perlepes, dan. Manessi-Zouopa, j. Chem. Soc. Dalton Trans, 1327.
- Robert m. Berne, Matthew N. Retribusi. (2001) Fisiologi. (Edisi ke -3.) Edisi harcourt, s.KE.
- Barat, J. B. (1991). Dasar fisiologis dari praktik medis. Williams & Wilkins
- « Karakteristik erythropoietin (EPO), produksi, fungsi
- Karakteristik, struktur dan fungsi distrofin »

