Struktur hidrogen peroksida (H2O2), sifat, penggunaan, mendapatkan

- 1581
- 94
- Irvin Reichel
Dia hidrogen peroksida Itu adalah senyawa anorganik yang formula kimianya h2SALAH SATU2. Setiap orang adalah peroksida paling sederhana dari keluarga senyawa kimia ini. Formula strukturalnya adalah H-o-h, jembatan teroksigenasi internal ini menjadi karakteristik untuk semua peroksida.
Pada 1818, h2SALAH SATU2 Itu diidentifikasi oleh Louies Jacques Thénard, yang menyiapkan senyawa kimia yang ia panggil kemudian huzigenada. Ini adalah senyawa yang tidak stabil, terurai dengan paparan cahaya, panas dan beberapa logam.
 Formula kimia hidrogen peroksida
Formula kimia hidrogen peroksida Ini adalah senyawa yang sangat berguna yang digunakan dalam desinfeksi luka ringan, pemutihan rambut, pengolahan air, dll. Meskipun ia dapat memiliki tindakan berbahaya bagi manusia, itu ditemukan di semua sel eukariotik makhluk hidup, di mana ia melakukan beberapa fungsi yang bermanfaat.
Hidrogen peroksida menghasilkan oksidasi zat beracun seperti fenol, etanol, formaldehida, dll., produk yang dihilangkan oleh hati dan ginjal. Selain itu, ini berkontribusi pada penghancuran bakteri yang difagosit oleh leukosit neutrofil dan makrofag.
[TOC]
Struktur
Molekul
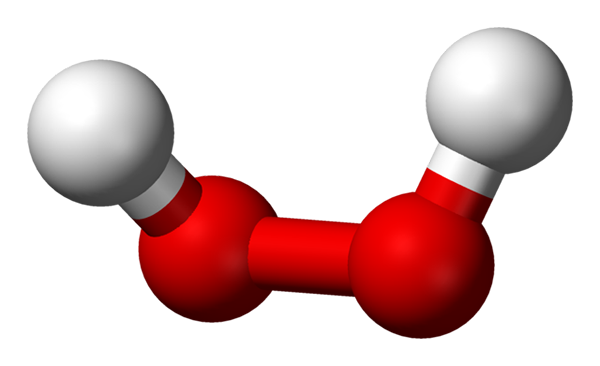 Molekul hidrogen peroksida diwakili dengan model bola dan batang. Sumber: Benjah-BMM27 via Wikipedia.
Molekul hidrogen peroksida diwakili dengan model bola dan batang. Sumber: Benjah-BMM27 via Wikipedia. Dalam gambar superior struktur molekul H dapat dilihat2SALAH SATU2 (H-o-o-h), dengan bola merah yang sesuai dengan atom oksigen, dan atom hidrogen putih. Perhatikan bahwa molekulnya tidak datar, dan bahwa atom -atom H tidak dikalahkan di ruang angkasa (satu di depan yang lain).
Menariknya, untuk h2SALAH SATU2 Sulit untuk memutar tautan pusat sederhana O-O, sehingga posisi H ini tidak dapat ditukar; satu tidak akan turun sementara yang lain naik.
Karena? Karena dalam dua atom oksigen ada dua pasangan bebas elektron, yang memberikan total delapan elektron yang sangat dekat dan yang saling mengusir untuk muatan negatif mereka.
Rotasi
Meski begitu, tautan O-O kemungkinan akan berputar karena interaksi dengan lingkungannya.
Misalnya, ketika bersama -sama dengan dua ibu jari, dengan jari -jari diperpanjang dan yang lain ditutup, seperti menggambar pengadilan, dan kemudian memutar jempol sedemikian rupa sehingga salah satu jari target ke depan dan yang lain ke belakang, akan ada a Perkiraan representasi h2SALAH SATU2.
Jika tubuh memainkan salah satu indeks, ibu jari akan berputar sebagai respons terhadap interaksi ini; Namun, mereka akan segera kembali ke posisi semula karena tolakan elektronik yang disebutkan di atas. Rotasi ini membingkai aspek dinamis dari molekul ini.
Interaksi antarmolekul
Dalam keadaan cair h2SALAH SATU2 berhasil membangun jembatan hidrogen (Hooh-O2H2), jika tidak, titik didihnya yang tinggi (150 ºC) tidak akan dijelaskan dibandingkan dengan air.
Dapat melayani Anda: kalsium sulfat (case4): struktur kimia, sifat, penggunaanSetelah melewati fase gas, molekul M2SALAH SATU2 Agaknya tidak dapat lagi membentuk jembatan seperti itu, tidak hanya dengan jarak antar molekul terbesar, tetapi juga atom hidrogen akan menjadi yang pertama disentuh jika terjadi tabrakan (ini dapat divisualisasikan dengan menggunakan kembali ke model jari).
Sementara itu, dalam fase padat sudut bidang yang menetapkan h adalah 90º (letakkan jari tegak lurus) jari)). Sekarang jembatan hidrogen menjadi lebih penting dan molekul H2SALAH SATU2 Mereka dipesan dalam kristal struktur tetragonal.
Properti
Sbotella dengan hidrogen peroksida. Di apotek dicapai dengan konsentrasi 3% m/v. Sumber: Pixnio.
Nama
-Hidrogen peroksida
-Dioxidano
-Oksidanol
-Asam Perhydoxic
-O-hydroxyol
-Hidrogen peroksida
Masa molar
34.0147 g/mol
Penampilan fisik
Biru pucat (terkonsentrasi) atau tidak berwarna. Itu sedikit lebih kental dan padat daripada air. Itu disuling untuk keamanan pada suhu rendah dan berkurangnya tekanan, karena terurai dengan pemanasan secara eksplosif.
Bau
Akut atau bau yang mirip dengan ozon.
Rasa
Pahit
Kepadatan
Solid 1,71 g/cm3
Kepadatan larutan air mereka tergantung pada konsentrasi mereka; Misalnya, 27 % memiliki kepadatan 1,10 g/cm3, sedangkan 50 %, 1,13 g/cm3
Titik lebur
- 0,43 ºC
Titik didih
150.2 ºC. Nilai ini telah diperoleh dengan ekstrapolasi, karena hidrogen peroksida terurai pada suhu tinggi.
Kelarutan air
MARMBLE ≥ 100 mg/mL pada 25 ° C
Kelarutan
Itu larut dalam eter dan alkohol, tetapi tidak larut dalam eter minyak. Ini terurai dalam air dan oksigen dalam banyak pelarut organik.
Koefisien Partisi Octanol/Air
Log p = - 0,43
Tekanan uap
5 mmHg pada 30 ºC.
Konstan disosiasi
PKA = 11,72
ph
Larutan hidrogen peroksida sedikit asam. Misalnya, satu hingga 35% memiliki pH 4,6; Tetapi ketika berkonsentrasi pada 90%, pH menjadi kurang asam: 5.1.
Indeks refraksi (nD)
1.4061
Zat yang lengket dan kental
1.245 cpoise pada 20 ° C.
Kapasitas panas
1.267 j/g · k (gas)
2.619 J/G · K (cairan)
Panas penguapan
1.519 j/g · k
Stabilitas
Stabil dalam kondisi yang disarankan. Penambahan asetanylide dan garam timah lebih menstabilkannya.
Korosi
Korosif
Penguraian
Itu terurai dengan paparan cahaya atau dengan adanya zat pengoksidasi dan pereduksi. Itu juga dipecah dengan pemanasan. Ketika disita, air dan oksigen dilepaskan, dan disukai oleh peningkatan pH dan suhu, serta dengan adanya enzim catlase.
Dapat melayani Anda: natrium peroksida (na2o2): struktur, sifat, penggunaanTegangan permukaan
80,4 Dins/cm A 20 ºC
Reaktivitas
H2SALAH SATU2 Itu bertindak sebagai agen pengoksidasi dalam larutan asam besi besi (iman2+) Besi besi (f3+); juga mengoksidasi ion sulfit (jadi32-) ke ion sulfat (jadi42-).
Ini juga dapat bertindak sebagai agen pereduksi di hadapan larutan dasar, mengurangi natrium hipoklorit (NAOCL) dan kalium permanganat (kmno4) Dengan rilis oksigen.
Aplikasi
Pemutih
Hidrogen peroksida digunakan dalam industri kertas dalam pemutihan pulpa dan kertas, yang menghabiskan sebagian besar produksi tahunannya.
Desinfektan
Hidrogen peroksida adalah antiseptik yang lembut untuk menghindari infeksi luka kecil, goresan dan luka bakar. Ini juga digunakan sebagai bilas mulut dan untuk menghilangkan iritasi mulut ringan karena adanya corong atau gingivitis.
Ini juga digunakan untuk mendisinfeksi permukaan, interior lemari es, air dan memerangi pertumbuhan bakteri yang berlebihan dalam sistem air dan menara pendingin. Hidrogen peroksida melepaskan radikal bebas oksigen, yang menguraikan polutan.
Deterjen
Hidrogen peroksida digunakan dalam pembuatan deterjen pemutih pakaian, termasuk natrium karbonat. Senyawa ini adalah kompleks natrium karbonat dan hidrogen peroksida yang dilarutkan dalam air terpisah dalam komponennya.
Aplikasi Kosmetik
Hidrogen peroksida encer digunakan dalam pemutihan rambut, sebelum pewarnaan. Ini juga digunakan untuk memutihkan gigi, sebagai bagian dari krim gigi buatan sendiri.
Bahan pembakar
Hidrogen peroksida digunakan sebagai komponen monoporpellant atau pengoksidasi roket bipropoon. Itu memecah melepaskan oksigen dan air, karakteristik yang memungkinkan penggunaannya sebagai propelan.
Sel reaksi dipompa dengan adanya katalis yang mempercepat dekomposisi tersebut. Selama ini, uap air diproduksi pada suhu tinggi.
Saat uap dikeluarkan melalui celah menghasilkan dorongan hati. Kapal selam V-80 yang dibangun pada tahun 1940, digunakan dalam turbin oksigen yang dihasilkan dari hidrogen peroksida; Disebut Walter Turbine System.
Memperoleh
Awalnya hidrogen peroksida diperoleh secara industri dengan hidrolisis amonium persulfat, [(NH4)2S2SALAH SATU8] atau elektrolisis amonium bisulfat, NH4Hso4.
Hidrogen peroksida diperoleh secara industri melalui penggunaan antraquinone. Proses ini dilakukan dalam empat tahap: hidrogenasi, penyaringan, oksidasi, ekstraksi dan pemurnian.
Dapat melayani Anda: magnesium fluoride: struktur, sifat, sintesis, penggunaanHidrogenasi
Alquilantroquinona dihidrogenasi dengan melewati gas hidrogen melalui hidrogenator yang diisi dengan alumina dan sejumlah kecil katalis (paladium). Suhu dipertahankan pada 45 ºC dengan agitasi permanen.
Alkyndroquinone dikonversi menjadi Alquiloantrahydroquinona dan Tetrahydroalquilantrahydroquinone, memilih yang terakhir untuk kenyamanan terbesarnya untuk prosedur berikut ini.
Penyaringan
Solusinya terkandung.
Oksidasi
Larutan yang disaring teroksidasi dengan melewati udara, membentuk hidrogen peroksida kemurnian rendah.
Ekstraksi dan pemurnian
Solusi dengan hidrogen peroksida melintasi kolom ekstraksi cair-cair. Air mengalir melalui kolom, sedangkan larutan dengan hidrogen peroksida dipompa olehnya.
Air mencapai bagian bawah ekstraktor dengan konsentrasi hidrogen peroksida antara 25 dan 35 % P/P. Kemudian, dimurnikan dengan distilasi vakum, ke konsentrasi hidrogen peroksida 30 %. Akhirnya distabilkan dan disimpan.
Risiko
 Hidrogen peroksida terbakar. Sumber: Bobjgalindo [CC BY-SA 3.0 (https: // createveCommons.Org/lisensi/by-sa/3.0)]
Hidrogen peroksida terbakar. Sumber: Bobjgalindo [CC BY-SA 3.0 (https: // createveCommons.Org/lisensi/by-sa/3.0)] Hidrogen peroksida adalah agen korosif, sehingga kontak kulit menghasilkan iritasi yang parah, selain pemutihan sementara (gambar superior). Ini juga dapat menghasilkan kerusakan mata, gatal, salpt, kemerahan dan formasi ampul.
Inhalasinya menghasilkan iritasi di hidung, tenggorokan dan paru -paru. Sementara itu, paparan berulang dapat menyebabkan bronkitis, batuk, dahak dan pemendekan pernapasan. Dan seolah -olah itu tidak cukup, itu juga menghasilkan sakit kepala, vahid, mual dan muntah.
Paparan serius terhadap hidrogen peroksida dapat menghasilkan akumulasi cair di paru -paru, yang dikenal sebagai edema paru: kondisi serius yang membutuhkan perhatian medis yang cepat.
Administrasi Keselamatan dan Kesehatan Kerja (OSHA) telah menetapkan maksimum yang diizinkan untuk hidrogen peroksida 1 ppm di lingkungan kerja dalam 8 jam sehari. Namun, karena itu adalah senyawa mutagenik, paparan minimum harus dikurangi.
Referensi
- Shiver & Atkins. (2008). Kimia anorganik. (Edisi keempat). MC Graw Hill.
- Wikipedia. (2019). Hidrogen peroksida. Diperoleh dari: di.Wikipedia.org
- William r. Busing dan henri a. Retribusi. (2004). Struktur kristal dan molekul hidrogen peroksida: studi neutron - difraksi. doi.org/10.1063/1.1696379
- Pusat Nasional Informasi Bioteknologi. (2019). Hidrogen peroksida. Database pubchem. CID = 784. Pulih dari: pubchem.NCBI.Nlm.Nih.Pemerintah
- Para editor Eeritlopaedia Britannica. (27 November 2018). Hidrogen peroksida. Encyclopædia Britannica. Dipulihkan dari: Britannica.com
- Departemen Kesehatan New Jersey. (2016). Hidrogen peroksida. [PDF]. Pulih dari: NJ.Pemerintah
- Mathews, c. K., Van Holde, K. DAN., Ahern, k. G. (2002). Biokimia. Edisi ketiga. Editorial Pearson Addison Wesley
- Web MD. (2019). Hidrogen peroksida. Diperoleh dari: webmd.com
- « Aztec Medicine History, Tuhan, Tanaman, Penyakit
- Struktur seng oksida (ZnO), sifat, penggunaan, risiko »

