Dasar -dasar potensiometri, persamaan, elektroda
- 3697
- 425
- Herbert Fritsch
Itu Potensiometri Ini adalah teknik analisis elektrokimia yang didasarkan pada pengukuran tegangan, medium atau kompartemen, dengan mana aktivitas atau konsentrasi suatu spesies (ionik atau molekuler) yang menarik ditentukan. Ini adalah teknik yang tidak merusak, karena tidak berusaha memodifikasi sifat kimia analit yang dimaksud.
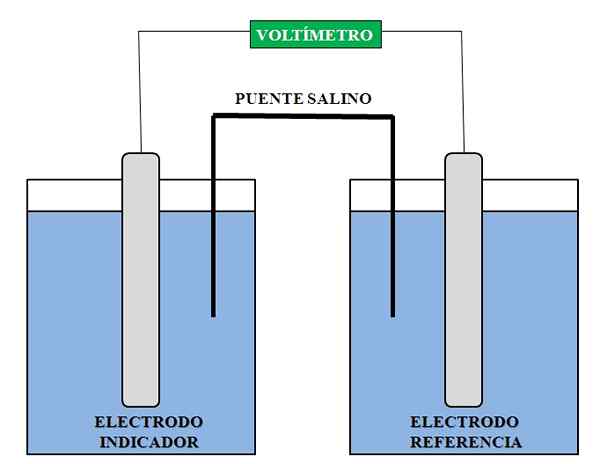
Untuk melakukan analisis ini, setidaknya dua elektroda sangat diperlukan: salah satu referensi dan indikator atau pekerjaan lainnya. Demikian juga, harus ada voltmeter impedansi tinggi, dengan mana tegangan diukur tanpa membiarkan aliran elektron yang cukup besar antara dua elektroda dan solusi yang mengelilinginya.
 Representasi umum dari elemen yang diperlukan untuk analisis potensiometri. Sumber: Gabriel Bolívar.
Representasi umum dari elemen yang diperlukan untuk analisis potensiometri. Sumber: Gabriel Bolívar. Di atas kami memiliki representasi umum dari Majelis untuk analisis potensiometri. Di kompartemen di mana elektroda indikator diperkenalkan adalah spesies yang konsentrasinya kami ingin tentukan; Sementara dalam elektroda referensi kami memiliki solusi lain, di mana kami tahu konsentrasi komponennya.
Pembacaan tegangan terdaftar, pada prinsipnya, karena spesies yang menarik mendekati elektroda indikator. Dengan tegangan ini kami menghitung konsentrasi spesies ini, misalnya, yaitu ion Ca2+, Ag+, H+, Na+, K+, Cl-, dll. Potensiometri telah menggunakan, oleh karena itu, dalam kimia klinis, lingkungan, analitik dan fisikokimia.
[TOC]
Fundamental
Tegangan yang ditentukan dalam analisis potensiometrik adalah sel, dansel, yang merupakan perbedaan antara tegangan yang disebabkan oleh dua elektroda, indikator dan referensi. Elektroda sensitif terhadap aktivitas molekul atau ion yang mengelilinginya, mampu menerima elektron dari mereka, atau sebaliknya menghasilkannya.
Dua kompartemen terhubung, sehingga elektroda elektroda mengalir di mana reduksi terjadi (katoda), ke elektroda di mana oksidasi (anoda) terjadi (anoda).
Namun, transfer elektron (atau arus) ini hampir nol, karena jika tidak, reaksi redoks akan berkembang untuk sepenuhnya memodifikasi konsentrasi dan identitas spesies yang terlibat.
Dapat melayani Anda: Hydrogen bromide (HBR)Sebaliknya, voltmeter hampir tidak memungkinkan lewatnya elektron, sehingga ada pembacaan tegangan yang stabil, dan bahwa sel dapat mencapai keseimbangan termodinamika.
Oleh karena itu dikatakan bahwa potensiometri adalah teknik yang tidak merusak, karena beberapa ion atau molekul diubah menjadi proses pengukuran, yang juga dapat dibalikkan.
Persamaan utama
Potensi sel
Potensi sel terkait dengan aktivitas atau konsentrasi spesies yang diminati melalui persamaan Nernst:
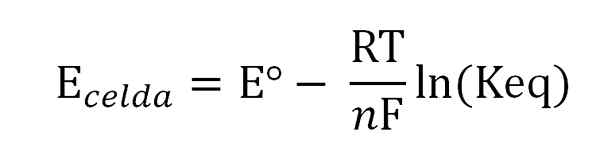 Persamaan Nernst. Sumber: Gabriel Bolívar.
Persamaan Nernst. Sumber: Gabriel Bolívar. Di mana eº adalah potensi sel yang sama dalam kondisi standar, f konstanta faraday, N Jumlah elektron yang ditransfer, r konstan gas, dan keq konstanta keseimbangan dari reaksi global. Perhitungan dibuat dengan membersihkan KEQ dari pembacaan Esel, dan menghitung konsentrasi ekspresi keseimbangan yang diinginkan.
Namun, lebih mudah untuk menghitung konsentrasi dengan rute yang lebih mudah. Dengan konvensi, potensi sel juga diberikan oleh persamaan berikut:
DANsel = Ekisi- DANsapi
Dimana ekisi Ini adalah potensi untuk reduksi semi -media, di mana elektroda indikator berada; sementara esapi Ini adalah potensi semi -media oksidasi, di mana kami memiliki elektroda referensi. Dengan demikian, persamaan dapat ditulis ulang sebagai:
DANsel = Eindikator - DANreferensi + DANJ
Menjadi eJ sama dengan potensi yang disebabkan oleh sambungan jembatan sambungan. Dalam praktiknya, danJ Itu tidak dapat ditentukan, tetapi memastikan bahwa nilainya minimal mungkin menggunakan solusi yang sangat encer, atau memastikan bahwa komposisi di kedua kompartemen itu serupa.
Potensi analit
Dari persamaan sebelumnya kita dapat menghitung danindikator, yang merupakan potensi yang benar -benar menarik minat kita. Dengan nilai itu, kami menerapkan persamaan Nernst lagi:
Dapat melayani Anda: asetonitril (C2H3N)DANindikator = Eº - (RT/NF) LN (merah/sapi)
Jaringan adalah pengurangan bentuk analit atau spesies yang diminati, dan sapi adalah bentuk teroksidasi. Dengan asumsi bahwa analit adalah kation zn2+ Pada elektroda seng logam, kami akan memiliki:
DANindikator = EºZn2+/zn - (Rt/nf) ln (1/keZn2+)
Di mana keZn2+ Itu adalah aktivitas kation zn2+, yang dengan penyesuaian eksperimental cukup dekat dengan konsentrasinya, [Zn2+]. Dari persamaan ini konsentrasi Zn dibersihkan2+, bahwa seperti yang dapat dilihat, secara langsung mempengaruhi nilai eindikator.
Bentuk seng, Zn, menyajikan aktivitas yang sama dengan 1. Oleh karena itu, persamaan umum untuk kation logam yang berkarat yang bertindak sebagai elektroda akan sama dengan:
DANindikator = EºMn+/m - (Rt/nf) ln (1/keM+N)
Tapi ini hanya berlaku dalam kasus elektroda spesies pertama.
Elektroda
Elektroda, selain voltmeter, adalah elemen terpenting dari setiap analisis potensiometri. Beberapa dari mereka akan disebutkan di bawah.
Spesies pertama
Elektroda spesies pertama adalah logam yang teroksidasi untuk menyebabkan kation, melakukan elektron ke voltmeter. Beberapa di antaranya adalah sebagai berikut: Ag, Zn, Cu, HG, SN, TL, CD dan BI.
Tidak semua logam berfungsi sebagai elektroda kelas pertama, karena mereka tidak boleh menghadirkan penyimpangan atau permukaan kristal yang ditutupi oleh lapisan oksida yang menyebabkan tegangan tidak stabil.
Spesies kedua
Elektroda spesies kedua, di sisi lain, juga merupakan logam, tetapi juga mengandung garam di permukaannya, yang kelarutannya tergantung pada reaksi redoks yang terjadi. Misalnya, elektroda AG-AGCL dan HG-HG2Cl2 (Calomel), adalah elektroda spesies kedua.
Ion selektif
Elektroda ion selektif, juga dikenal sebagai membran, adalah yang sensitif terhadap ion atau molekul tertentu, yang menyelinap melalui membran yang dirancang hanya untuk dia lulus dan bukan spesies lain dalam larutan.
Dapat melayani Anda: pembatasan dan reagen berlebihanContoh favorit dari jenis elektroda ini adalah kaca, dibangun untuk menentukan konsentrasi ion H3SALAH SATU+ atau h+, Dan dengan demikian berfungsi sebagai pehometer.
Aplikasi potensiometri
Kimia Enviromental
Potensiometri telah digunakan dalam kimia lingkungan dalam penentuan ion CN-, F- dan tidak3-, serta amonia dalam arus air.
Kimia Klinis
Elektroda selektif sangat berguna saat media pengukuran kompleks. Oleh karena itu, ion atau molekul lain akan mengganggu pembacaan.
Karakteristik ini sangat bermanfaat dalam penentuan potensiometrik yang dilakukan dalam sel yang sama, di mana mikroelektroda disuntikkan untuk menentukan konsentrasi KK+, Na+, Cl-, Ac2+ atau h+.
Derajat potensiometrik
Misalkan di tengah di mana kami memiliki indikator elektroda judul ditambahkan yang bereaksi dengan analit dan, oleh karena itu, ia memodifikasi konsentrasinya. Maka perubahan akan terjadi di esel, yang akan sesuai dengan cara yang sama dengan perubahan pH dalam titrasi asam-basa.
Dengan demikian, grafik dansel Vs. VTitulan, Kita dapat menentukan titik balik atau kesetaraan, dan dengan itu kita akan mengetahui konsentrasi analit.
Gelar potensiometrik banyak digunakan di laboratorium kimia analitik dan fisikokimia. Beberapa analit yang dapat ditentukan dengan teknik ini adalah sebagai berikut: iman2+, HCO3-, Ac2+, Mg2+, Cu2+, Asam askorbat, haluros, antara lain.
Semua derajat, sampai batas tertentu, dapat diikuti melalui potensiometrik alih -alih menggunakan indikator dan poin akhir mereka.
Referensi
- Hari, r., & Underwood, a. (1986). Kimia analitik kuantitatif (Edisi kelima.). Pearson Prentice Hall.
- Skoog d.KE., Barat d.M. (1986). Analisis instrumental. (Ed kedua.). Inter -American., Meksiko.
- Kata. Doug Stewart. (2020). Definisi potensiometri. Pulih dari: chemicool.com
- Harvey David. (5 Juni 2019). Metode potntiometrik. Libretteks Kimia. Pulih dari: chem.Librettexts.org
- Britannica Encyclopaedia. (2020). Electrogravimetry. Dipulihkan dari: Britannica.com
- Wikipedia. (2020). Metode elektroanalitik. Diperoleh dari: di.Wikipedia.org
- « Operasi elektroda kalom, karakteristik, penggunaan
- Jenis obat yang merangsang dan karakteristiknya »

