Operasi elektroda kalom, karakteristik, penggunaan

- 1416
- 252
- Domingo Gutkowski
Dia Elektroda Calomel o Calomelanes adalah elektroda sekunder yang memungkinkan untuk menentukan potensi semi -kehidupan, berkat reaksi yang terjadi antara merkuri dan merkuri klorida (I), Hg2Cl2, sebelumnya dikenal sebagai calomel. Kedua reagen, HG dan HG2Cl2, Mereka menang atau kehilangan elektron tergantung pada media di mana elektroda terbenam.
Biasanya disingkat EC, elektroda ini menggantikan dalam banyak pengukuran elektroda hidrogen standar (SHE), karena lebih mudah dibangun, dan kurang berisiko untuk dimanipulasi (meskipun memiliki merkuri). Di dalamnya mengandung larutan KCL sebagai media elektrolitik untuk aliran elektron.
 Elektroda kalomel dalam pengukuran penuh. Sumber: Chandrajit Karmakar, CC BY-SA 4.0, via Wikimedia Commons
Elektroda kalomel dalam pengukuran penuh. Sumber: Chandrajit Karmakar, CC BY-SA 4.0, via Wikimedia Commons Elektroda kalomel dapat memiliki varian yang berbeda tergantung pada ukurannya, atau lebih penting, dari konsentrasi KCL. Ketika solusi KCL jenuh, kami berbicara tentang elektro dari saturado calomel (ESC). ESC lebih mudah disiapkan daripada EC, tetapi lebih sensitif terhadap perubahan suhu.
Penggunaan elektroda ini telah memungkinkan untuk menentukan potensi semi -kehidupan untuk reaksi redoks yang tak terhitung banyaknya. Ini juga merupakan perangkat yang berulang dalam penentuan potensiometri, yang berusaha mengetahui jumlah analit tergantung pada sel dan potensi yang diukur.
[TOC]
Berfungsi
Jadi elektroda calomel itu bekerja, pasangan hg-hg2Cl2 Anda harus bereaksi, apakah menang atau kehilangan elektron.
Katodik
Ketika reduksi atau gain elektron terjadi di dalam elektroda kalomel, kami memiliki reaksi berikut:
HG2Cl2 → Hg22+ + 2cl- (Ionisasi)
HG22+ + 2e- → 2hg (reduksi)
HG2Cl2 + 2e- → 2hg +2cl- (Reaksi bersih)
Dapat melayani Anda: reaksi eksotermikOleh karena itu, HG2Cl2 Menangkan elektron yang dikurangi menjadi merkuri logam.
Potensi E elektroda ketika reduksi terjadi diberikan oleh persamaan:
E = Eº - 0.0591 log [cl-]
Di mana diamati bahwa itu tergantung secara eksklusif pada konsentrasi ion CL-, Menjadi potensi reduksi standar untuk elektroda yang diukur ini di depan elektroda hidrogen standar.
Anodik
Dalam elektroda, proses oksidasi juga dapat terjadi:
2HG → HG22+ + 2e- (Oksidasi)
HG22+ + 2cl- → Hg2Cl2 (Pengendapan)
2hg +2cl- → Hg2Cl2 + 2e- (Reaksi bersih)
Yaitu, merkuri teroksidasi untuk menghasilkan lebih banyak Hg2Cl2.
Potensi E dalam kasus ini diberikan oleh:
E = eº + 0.0591 log [cl-]
Dan lagi, dan itu tergantung pada [CL-].
Reaksi umum
Reaksi umum untuk elektroda calomel adalah:
HG2Cl2(s) + 2e- ⇌ 2hg (l) + 2cl-
Rasa keseimbangan akan tergantung pada media di mana elektroda menghubungi Anda. Cl- Tentukan kelarutan HG2Cl2, yang pada gilirannya berdampak pada pembentukan atau oksidasi Hg.
Dan potensi yang ditentukan untuk konsentrasi ion CL tertentu- Itu akan sama dengan:
DANCalomel = Ekisi - DANsapi
Menjadi eCalomel Potensi yang dilaporkan sebagai referensi dalam tabel potensial tertentu.
Karakteristik elektroda calomel
Representasi semi
Calomel Electrode Semi -Edge dapat direpresentasikan sebagai berikut:
PT | HG | HG2Cl2| Cl- (Xm)
Di mana hanya konsentrasi ion CL yang penting-, diekspresikan dalam molaritas atau normalitas. Potensi E elektroda akan bervariasi jika diisi dengan solusi dari konsentrasi KCl yang berbeda.
Misalnya, EC dengan KCL 0.1 m memiliki a dan sama dengan 0.3356 V pada 25 ° C; Sedangkan ESC, dengan KCl jenuh, memiliki satu dan sama dengan 0.2444 V pada suhu yang sama.
Dapat melayani Anda: isopentano: struktur, sifat, penggunaan, mendapatkanOleh karena itu, konsentrasi KCL adalah karakteristik paling penting dari elektroda kalomel, karena akan menunjukkan apa yang akan digunakan ketika perhitungan pengukuran potensiometri dilakukan.
Secara komersial, tiga jenis elektroda kalomel tercapai: jenuh (ESC), yang kesembilan belas (0.1 N atau 0.1 m kcl) dan normal (1 N atau 1 M KCl). Elektroda Calomel 1 M KCl akan direpresentasikan sebagai:
PT | HG | HG2Cl2| Cl- (1 m)
Para Pihak
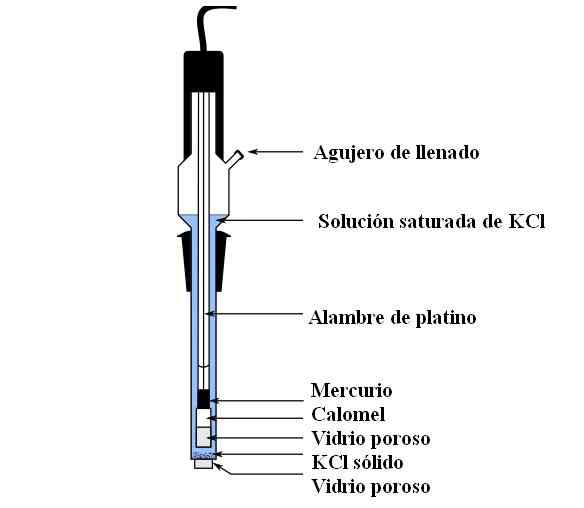 Bagian Elektroda Calomel. Sumber: Bachi-Bouzou, CC0, via Wikimedia Commons
Bagian Elektroda Calomel. Sumber: Bachi-Bouzou, CC0, via Wikimedia Commons Di gambar atas kami menunjukkan bagian utama elektroda kalomel biasa. Itu terbuat dari kaca, dan terdiri dari dua wadah: yang eksternal, yang dimasukkan ke dalam kontak elektrokimia dengan media pengukuran dan berisi solusi KCL; Dan yang dalam, di mana campuran HG-HG bersandar2Cl2.
Secara internal, elektroda calomel mengandung merkuri cair, di mana pasta HG dipatuhi2Cl2 dibasahi dengan merkuri. Ini adalah fase elektroda yang paling aktif. Kaca berpori digunakan hanya untuk memungkinkan masuk atau keluar dari ion CL-, Tapi bukan kristal HG2Cl2 atau tetes merkuri.
Kabel platinum, di mana aliran elektron, terendam dalam merkuri, dan bertanggung jawab untuk menghubungkan elektroda dengan voltmeter dan sirkuit eksternal yang dimaksud.
Melalui lubang pengisian, larutan KCL dituangkan, yang mengandung garam terlarut. Sementara itu, di bagian bawah elektroda kami memiliki lubang yang sangat kecil dalam kaca berpori, yang bersentuhan langsung dengan media pengukuran. Tujuan dari kaca berpori adalah untuk memungkinkan kontak tanpa pertukaran zat yang tidak diinginkan yang mencemari elektroda atau sampel.
Itu dapat melayani Anda: cyclohexen: struktur, sifat, sintesis dan penggunaanKeuntungan
Elektroda Calomel menyajikan keunggulan berikut sehubungan dengan elektroda hidrogen standar:
-Mudah dibangun dan dimanipulasi
-Potensi selnya tetap konstan bahkan jika air menguap
-Anda tidak membutuhkan jembatan saline
ESC adalah yang termudah untuk dibangun dari elektroda kalomel, karena KCL cukup untuk larut sampai kristal mereka terbentuk. Maka solusinya akan jenuh, dan siap untuk ditumpahkan di dalam elektroda.
Kerugian
Elektroda Calomel, bagaimanapun, menyajikan kerugian berikut:
-Dengan mengandung merkuri cair, ia dapat melakukan dampak negatif pada lingkungan
-Itu tidak dapat digunakan untuk analisis kuantitatif dalam sampel dengan suhu lebih besar dari 60 ºC, karena Hg2Cl2 mulai rusak, menyebabkan pembacaan elektroda gagal
ESC juga memiliki kelemahan yang sangat sensitif terhadap perubahan suhu.
Elektroda perak perak telah menggantikan kalomel dalam banyak penentuan potensiometri.
Aplikasi
Elektroda Calomel adalah salah satu dari banyak elektroda yang digunakan setiap hari dalam penentuan potensiometri, memungkinkan untuk mendapatkan potensi semi -kehidupan analit atau spesies yang diminati.
Juga, elektroda kalomel digunakan dalam pengukuran pH dan voltmetri siklus.
Referensi
- Hari, r., & Underwood, a. (1986). Kimia analitik kuantitatif (Edisi kelima.). Pearson Prentice Hall.
- Wikipedia. (2020). Elektroda Calomel Jenuh. Diperoleh dari: di.Wikipedia.org
- Umum, eni. (20 Oktober 2018). Kalomel elektroda. Kamus & Glosari Kimia Kroasia-Inggris. KTF-split. 30 Oktober. 2020. Pulih dari: glosarium.Periodni.com
- Skoog d.KE., Barat d.M. (1986). Analisis instrumental. (Ed kedua.). Inter -American., Meksiko.
- Bukit, g., Ives, d. T. (1950). Elektroda Calomel. Alam 165, 530 doi.org/10.1038/165530A0
- Jmgav. (9 Desember 2012). Potensiometri (II): Elektroda. Diperoleh dari: Triplenlace.com
- « Karakteristik Paradigma Sosial, Metode, Perwakilan
- Dasar -dasar potensiometri, persamaan, elektroda »

