Prinsip Le Châtelier

- 3682
- 852
- Leland Robel
Apa prinsip le châtelier?
Dia Prinsip Le Châtelier Ini adalah aturan umum yang memprediksi efek bahwa berbagai faktor yang mempengaruhi keseimbangan kimia. Secara khusus, ini membantu memprediksi ke arah mana reaksi yang seimbang akan bergerak ketika keseimbangan tersebut terganggu oleh agen eksternal.
Prinsip ini menetapkan itu:
"Ketika suatu sistem yang berada dalam kesetimbangan mengalami gangguan atau tegangan eksternal, sistem bereaksi ke arah yang memungkinkannya untuk menangkal gangguan tersebut".
Gangguan dipahami dengan baik:
- Perubahan konsentrasi reagen mana pun.
- Perubahan konsentrasi produk salah satu.
- Perubahan tekanan.
- Perubahan volume.
- Perubahan suhu
Ketika perubahan terjadi seperti yang disebutkan, salah satu dari dua reaksi, langsung atau terbalik, disukai sehubungan dengan yang lain, sehingga sistem bereaksi dalam arti yang bergerak menuju keadaan keseimbangan baru.
Ini mirip dengan penyesuaian yang dilakukan oleh penyeimbang di atas tali. Saat gravitasi hala di satu sisi, penyeimbang bereaksi dengan bergerak ke sisi yang berlawanan. Kami mengatakan bahwa keseimbangannya bergerak, karena dia masih seimbang (dia tidak jatuh), tetapi sekarang dia memiliki posisi yang berbeda.
Selanjutnya, kita akan melihat bagaimana prinsip le châtelier digunakan untuk memprediksi arah di mana suatu sistem akan bereaksi dengan menderita berbagai jenis ketegangan atau gangguan seperti: perubahan konsentrasi, volume, tekanan dan suhu.
Pengaruh Perubahan Konsentrasi
Misalkan kita memiliki reaksi berikut dalam keseimbangan:
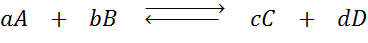
Jika kita mengubah konsentrasi salah satu spesies yang terlibat (a, b, c atau d), prinsip le châtelier memprediksi bahwa sistem akan bereaksi untuk menangkal perubahan ini baik mengkonsumsi kelebihan yang ditambahkan atau memulihkan jumlah yang dihilangkan yang dieliminasi. 4 situasi yang berbeda dapat diberikan:
1. Peningkatan konsentrasi reagen
Jika kita meningkatkan konsentrasi reagen, misalnya, sesuai dengan prinsip le châtelier, sistem akan bereaksi untuk mengkonsumsi kelebihan yang ditambahkan. Ini berarti bahwa itu akan bereaksi secara langsung (dari kiri ke kanan), karena arah ini dikonsumsi.
Dalam hal ini dikatakan bahwa reaksi langsung disukai dan bahwa keseimbangan bergerak ke arah produk, karena dalam keseimbangan baru konsentrasi produk lebih besar dari pada keseimbangan asli.
Dapat melayani Anda: pemisahan magnetik2. Peningkatan konsentrasi produk
Jika kita meningkatkan konsentrasi suatu produk, misalnya, C, sistem akan bereaksi secara terbalik untuk mengkonsumsi kelebihan C yang ditambahkan (yaitu, dari kanan ke kiri).
Dalam hal ini dikatakan bahwa reaksi terbalik disukai dan bahwa keseimbangan bergerak menuju reagen.
3. Penurunan konsentrasi reagen
Penurunan konsentrasi memiliki efek sebaliknya dengan peningkatan konsentrasi tersebut. Jika kita menarik diri dari medium, sehingga mengurangi konsentrasinya, sistem akan bereaksi ke kiri (secara terbalik) untuk menangkal perubahan. Keseimbangan bergerak menuju reagen.
4. Penurunan konsentrasi produk
Jika kita mengurangi konsentrasi C atau D, sistem akan bereaksi langsung untuk menggantikan konsentrasi penurunan (yaitu, dari kiri ke kanan). Keseimbangan bergerak menuju produk.
Contoh:
Tentukan efek menambahkan lebih banyak ion tiocianate (SCN-) Dalam keseimbangan kimia berikut, mengetahui bahwa produk hak adalah merah dan besi (III) yang kuat berwarna kuning.
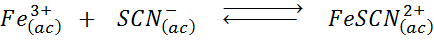
Larutan: Dalam hal ini, kami menambahkan tiocianato yang merupakan reagen, sehingga keseimbangan harus bergerak ke kanan, meningkatkan konsentrasi kompleks dan, oleh karena itu, intensitas warna merah dalam larutan.
Pengaruh Perubahan Volume dan Tekanan
Perubahan volume dan tekanan tidak secara signifikan mempengaruhi reaksi dalam keseimbangan dalam keadaan cair atau padat, tetapi mereka dapat mempengaruhi yang ditemukan dalam keadaan gas. Ini karena, untuk gas, konsentrasi sebanding dengan tekanan, seperti yang diprediksi oleh hukum gas ideal.
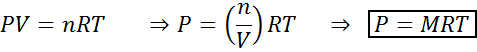
Meningkatkan tekanan gas yang mempertahankan suhu konstan setara untuk mengurangi volumenya, sehingga efek dari kedua gangguan akan sama.
Jika tekanan total meningkat ke reaksi keseimbangan dalam kesetimbangan (atau kami mengurangi volumenya), sistem akan bereaksi mencoba mengurangi tekanan tersebut lagi, sehingga keseimbangan akan bergerak ke tempat ada jumlah molekul partikel gas yang lebih kecil.
Dapat melayani Anda: kromatografi lapisan halus: karakteristik, untuk apa itu Dalam reaksi antara nitrogen dan hidrogen untuk membentuk amonia, 4 molekul soda dikonsumsi dan hanya dua yang diproduksi, sehingga peningkatan tekanan menggeser keseimbangan terhadap pembentukan amonia yang paling banyak
Dalam reaksi antara nitrogen dan hidrogen untuk membentuk amonia, 4 molekul soda dikonsumsi dan hanya dua yang diproduksi, sehingga peningkatan tekanan menggeser keseimbangan terhadap pembentukan amonia yang paling banyak Jika dalam reaksi mereka dikonsumsi dan jumlah molekul gas yang sama diproduksi, maka perubahan volume dan tekanan tidak akan mempengaruhi keseimbangan.
Di sisi lain, jika kita hanya memodifikasi tekanan parsial dari salah satu gas, efeknya sama dengan meningkatkan atau mengurangi konsentrasi spesies tersebut.
Contoh:
Mengingat reaksi dekomposisi dyitrogen tetroksida dalam keseimbangan:
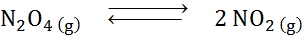
Tentukan efek pengurangan volume, meningkatkan tekanan.
Larutan: Jika kita meningkatkan tekanan sistem total atau mengurangi volumenya, keseimbangan bergerak menuju reagen, karena, ke arah itu, ada penurunan bersih molekul gas (2 dan 1) dikonsumsi 1) yang memungkinkan untuk menangkal peningkatan tekanan tekanan.
Pengaruh Perubahan Suhu
Efek suhu pada keseimbangan kimia berbeda dari faktor -faktor lain yang telah kita lihat sejauh ini. Dalam kasus sebelumnya, keseimbangan baru diperoleh setelah gangguan, tetapi konstanta keseimbangan yang sama dipertahankan. Namun, jika suhu berubah, konstanta kesetimbangan akan berubah.
Untuk mengetahui bagaimana konstanta kesetimbangan berubah dengan suhu, tanda entalpi reaksi perlu diketahui:
- Jika reaksi melepaskan panas, yaitu, itu adalah eksotermik, entalpi negatif, dan konstanta keseimbangan berkurang seiring dengan meningkatnya suhu meningkat. Dalam kasus ini, keseimbangan bergerak ke arah yang berlawanan menuju reagen.
- Jika reaksi menyerap panas, yaitu, endotermik, entalpi positif dan sebaliknya terjadi.
Mengingat efek suhu itu mudah jika kita menganggap panas sebagai reagen yang terjadi dalam kasus reaksi eksotermik dan dikonsumsi dalam kasus endotermik. Suhu yang meningkatkan akan seperti "tambahkan" panas ke sistem dan mendinginkannya akan setara untuk menghilangkannya.
Jadi, jika reaksi eksotermik dan suhunya meningkat, itu akan seperti menambahkan produk reaksi, sehingga keseimbangan bergerak ke arah yang berlawanan, menuju reagen, dan jika mendinginkan yang sebaliknya.
Itu dapat melayani Anda: asam píchrat: apa itu, struktur, sintesis, sifatDi sisi lain, jika reaksi adalah endotermik dan suhunya meningkat, itu akan seperti menambahkan reagen, sehingga keseimbangan bergerak ke arah produk, sedangkan penurunan suhu memiliki efek sebaliknya.
Contoh:
Reaksi dekomposisi n2SALAH SATU4 Ini memiliki entalpi reaksi +58,0 kJ/mol. Ke arah mana keseimbangan akan bergerak jika suhu menurun?
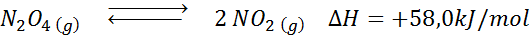
Larutan: Karena entalpi positif, reaksinya adalah endotermik. Untuk alasan ini, pendinginan itu akan mendukung reaksi terbalik, dan keseimbangan akan bergerak menuju reagen, yaitu, menuju pembentukan lebih banyak n2SALAH SATU4.
Efek katalis, inhibitor dan zat inert
Katalis dan inhibitor mempengaruhi kecepatan reaksi yang terjadi, tetapi mereka mempengaruhi reaksi langsung dan tidak langsung. Untuk alasan ini, mereka tidak mempengaruhi keadaan keseimbangan.
Di sisi lain, penambahan zat inert sebagai gas yang tidak bereaksi dengan reagen atau produk apa pun, tidak akan mempengaruhi reaksi langsung atau langsung, sehingga akan memiliki efek pada keseimbangan.
Penerapan Prinsip Le Châtelier
Memahami prinsip ini sangat berguna, karena memungkinkan kita untuk memanipulasi keadaan keseimbangan reaksi terhadap kenyamanan kita.
Dalam kasus -kasus di mana kami tertarik.
Ini berarti:
- Tambahkan sejumlah besar reagen, jika ini ekonomis.
- Menarik produk seiring berjalannya reaksi, untuk mempertahankan sistem dalam keadaan tegangan yang konstan, selalu berusaha mencapai keseimbangan bereaksi secara langsung.
- Tingkatkan suhu dalam kasus reaksi endotermik.
- Meningkatkan tekanan pada reaksi di mana lebih banyak molekul gase dikonsumsi daripada yang terjadi.
Kami mungkin juga ingin meminimalkan jumlah produk yang dibentuk oleh reaksi yang tidak diinginkan. Dalam kasus ini kami melakukan yang sebaliknya.
Contoh aplikasi dari prinsip le châtelier
Dalam sintesis organik prinsip le châtelier secara konstan digunakan untuk meningkatkan hasil reaksi.
Misalnya, dalam reaksi dehidrasi alkohol, pengeringan ditambahkan ke lingkungan yang menyerap air yang terbentuk selama reaksi. Ini mengurangi konsentrasi produk tersebut, yang menggantikan keseimbangan terhadap produk.

