Sifat berkala dari elemen dan karakteristiknya

- 2007
- 498
- Domingo Gutkowski
Itu Sifat periodik elemen Mereka adalah mereka yang mendefinisikan perilaku fisik dan kimianya dari perspektif atom, dan yang besarnya, selain bilangan atom, memungkinkan klasifikasi atom.
Dari semua sifat, ini ditandai, seperti namanya, karena mereka berkala; Yaitu, jika tabel periodik dipelajari, dapat disertifikasi bahwa besarnya mematuhi tren yang bertepatan dan diulang dengan pemesanan elemen dalam periode (baris) dan kelompok (kolom).
 Periodisitas intrinsik dari bagian dari unsur -unsur tabel periodik. Sumber: Gabriel Bolívar.
Periodisitas intrinsik dari bagian dari unsur -unsur tabel periodik. Sumber: Gabriel Bolívar. Misalnya, jika Anda melakukan perjalanan periode periodik dan properti berkurang dengan besarnya dengan setiap elemen, hal yang sama akan terjadi di semua periode. Di sisi lain, jika turun kelompok atau kolom, ia meningkatkan besarnya, hal yang sama dapat diharapkan untuk kelompok lain.
Dan dengan demikian, variasi mereka diulang dan dibuktikan tren sederhana yang setuju dengan pemesanan elemen untuk angka atom mereka. Sifat -sifat ini secara langsung bertanggung jawab atas sifat logam atau non -metalik elemen, serta reaktivitas mereka, yang telah membantu mengklasifikasikannya dengan kedalaman yang lebih besar.
Jika untuk sesaat identitas elemen tidak diketahui dan mereka dipandang sebagai "bola" yang aneh, tabel periodik dapat dibangun kembali (dengan banyak pekerjaan) memanfaatkan sifat -sifat ini.
Dengan cara ini, bidang yang seharusnya akan memperoleh warna yang memungkinkan mereka untuk membedakan mereka dari satu sama lain dalam kelompok (gambar superior). Mengetahui karakteristik elektronik mereka, mereka dapat berorganisasi dalam periode, dan kelompok -kelompok itu akan mengkhianati mereka yang memiliki jumlah elektron valensi yang sama.
Pembelajaran dan penalaran sifat periodik sama untuk mengetahui mengapa elemen bereaksi dalam satu atau lain cara; Mengetahui mengapa elemen logam berada di daerah tertentu dari tabel, dan elemen non -metalik di lain.
[TOC]
Apa sifat periodik dan karakteristiknya
-Radio atom
Saat mengamati bidang gambar, hal pertama yang dapat diperhatikan adalah bahwa tidak semua ukuran yang sama. Beberapa lebih besar dari yang lain. Jika diamati dengan detail yang lebih besar, akan ditemukan bahwa ukuran ini memvariasikan pola: dalam periode itu berkurang dari kiri ke kanan, dan dalam kelompok meningkat dari atas ke bawah.
Di atas juga dapat dikatakan dengan cara ini: jari -jari atom berkurang ke arah kelompok atau kolom kanan, dan meningkat pada periode atau baris yang lebih rendah. Dengan demikian, jari -jari atom adalah properti periodik pertama, karena variasinya mengikuti pola di dalam elemen.
Beban nuklir vs elektron
Apa pola ini? Dalam periode elektron atom menempati tingkat energi yang sama, yang terkait dengan jarak yang memisahkan mereka dari nukleus. Ketika kita berpindah dari satu kelompok ke kelompok lain (yang sama dengan melakukan perjalanan periode ke kanan), nukleus menambahkan elektron dan proton dalam tingkat energi yang sama.
Dapat melayani Anda: karbonOleh karena itu, elektron tidak dapat menempati jarak yang lebih jauh dari nukleus, yang meningkatkan beban positifnya karena memiliki lebih banyak proton. Akibatnya, elektron mengalami kekuatan daya tarik yang lebih besar terhadap nukleus, semakin menarik mereka karena jumlah proton meningkat.
Itulah sebabnya unsur -unsur di ujung kanan tabel periodik (kolom kuning dan pirus) memiliki radio atom yang lebih kecil.
Di sisi lain, ketika "melompat" dari satu periode ke periode lain (yang sama untuk mengatakan bahwa suatu kelompok turun), tingkat energi yang memungkinkan yang baru memungkinkan elektron untuk menempati ruang yang lebih jauh di dalam nukleus. Lebih jauh, nukleus (dengan lebih banyak proton) menarik mereka dengan kekuatan yang lebih sedikit; Dan karenanya radio atom meningkat.
Radio ionik
Radio ionik mematuhi pola yang mirip dengan radio atom; Namun, ini tidak terlalu bergantung pada nukleus, tetapi berapa banyak elektron atau kurang memiliki atom sehubungan dengan keadaan netralnya.
Kation (na+, Ac2+, Ke3+, Menjadi2+, Keyakinan3+) menunjukkan beban positif karena mereka telah kehilangan satu atau lebih elektron, dan oleh karena itu, nukleus menarik mereka dengan kekuatan yang lebih besar karena ada lebih sedikit ke arah di antara mereka. Hasilnya: kation lebih kecil dari atom dari mana mereka berasal.
Dan untuk anion (atau2-, F-, S2-, yo-) Sebaliknya, mereka menunjukkan beban negatif karena memiliki satu atau lebih elektron berlebih, meningkatkan dendamnya satu sama lain di atas daya tarik yang diberikan nukleus. Hasilnya: anion lebih besar dari atom dari mana mereka berasal (gambar lebih rendah).
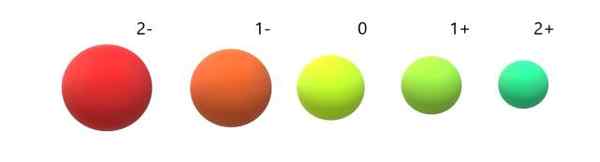 Variasi radio ionik sehubungan dengan atom netral. Sumber: Gabriel Bolívar.
Variasi radio ionik sehubungan dengan atom netral. Sumber: Gabriel Bolívar. Dapat dilihat bahwa anion 2- adalah yang paling tebal dari semua, dan kation 2+ yang terkecil. Radio meningkat ketika atom diisi secara negatif, dan berkontraksi ketika diisi secara positif.
-Elektronegativitas
Ketika elemen memiliki radio atom kecil, tidak hanya elektron mereka sangat tertarik, tetapi juga elektron atom tetangga ketika membentuk ikatan kimia. Kecenderungan untuk menarik elektron atom lain dalam suatu senyawa adalah apa yang dikenal sebagai elektronegativitas.
Yang satu atom kecil tidak berarti bahwa itu akan lebih elektronegatif. Jika demikian, elemen helium dan hidrogen akan menjadi atom yang paling elektronegatif. Helium ke tempat sains telah menunjukkan, tidak membentuk tautan kovalen dalam bentuk apa pun; Dan hidrogen, nyaris tidak memiliki satu proton dalam nukleus.
Dapat melayani Anda: tembaga sulfida: struktur, sifat, penggunaanKetika radio atom besar, inti tidak memiliki kekuatan yang cukup untuk menarik elektron atom lain; Oleh karena itu, elemen paling elektronegatif adalah mereka yang memiliki jari -jari atom kecil dan jumlah proton yang lebih besar.
Sekali lagi, mereka yang memenuhi karakteristik ini dengan sempurna adalah elemen non -metalik dari blok p dari tabel periodik; Ini adalah milik kelompok 16 atau oksigen (O, S, SE, TE, PO), dan Grup 17 atau Fluor (F, Cl, Br, I, at).
Kecenderungan
Menurut semua yang dikatakan, elemen paling elektronegatif terutama terletak di sudut kanan atas tabel periodik; memiliki fluoride sebagai elemen yang memimpin daftar yang paling elektronegatif.
Karena? Tanpa menggunakan skala elektronegativitas (Pauling, Mulliken, dll.), fluoror meskipun lebih besar dari neon (gas mulia periode), yang pertama dapat membentuk tautan sementara yang kedua tidak. Selain itu, untuk ukurannya yang kecil nukleusnya memiliki banyak proton, dan di mana fluor berada, akan ada momen dipol.
-Karakter logam
Jika suatu elemen memiliki jari -jari atom dibandingkan dengan yang dari periode yang sama, dan juga sedikit elektronegatif, maka itu adalah logam, dan memiliki karakter logam yang tinggi.
Jika kita kembali ke gambar utama, bola kemerahan dan kehijauan, seperti halnya abu -abu, sesuai dengan elemen logam. Logam memiliki karakteristik yang unik, dan dari sini sifat periodik dengan sifat fisik dan makroskopis materi mulai terjalin.
Unsur -unsur dengan karakter logam tinggi ditandai dengan atomnya yang relatif besar, mudah kehilangan elektron karena inti hampir tidak dapat menariknya ke arah mereka.
Akibatnya, mereka mengoksidasi atau kehilangan elektron dengan mudah membentuk kation, m+; Ini tidak berarti bahwa semua kation adalah logam.
Kecenderungan
Pada titik ini Anda dapat memprediksi bagaimana karakter logam dalam tabel periodik bervariasi. Jika diketahui bahwa logam memiliki radio logam besar, dan bahwa ada juga beberapa elektronegatif, elemen terberat (periode bawah) harus diharapkan, menjadi yang paling logam; dan elemen yang lebih ringan (periode atas), logam paling tidak.
Demikian juga, karakter logam mengurangi lebih banyak elektronegatif elemen dibuat. Ini berarti bahwa berkeliling periode dan kelompok di sebelah kanan tabel periodik, dalam periode yang lebih tinggi, akan memenuhi elemen logam paling tidak.
Oleh karena itu, karakter logam meningkat dengan turun oleh suatu kelompok, dan berkurang ke kanan ke kanan pada periode yang sama. Di antara elemen logam yang kita miliki: Na (natrium), li (lithium), mg (magnesium), BA (barium), ag (perak), au (emas), po (polonio), pb (timbal), cd (kadmium ), Ke (aluminium), dll.
Dapat melayani Anda: titik didih: konsep, perhitungan, dan contoh-Energi ionisasi
Jika sebuah atom memiliki jari -jari atom yang besar, diharapkan nukleusnya tidak menjaga elektron menjadi kekuatan yang cukup besar di lapisan terluar paling baik. Akibatnya, menghilangkannya dari atom dalam fase gas (individual) tidak akan membutuhkan banyak energi; Ini adalah, energi ionisasi, EI, perlu untuk mengambil elektron.
Yang juga sama untuk mengatakan bahwa itu adalah energi yang harus dipasok untuk mengatasi gaya tarik nukleus atom atau ion gas pada elektron terluarnya. Semakin kecil atom dan lebih elektronegatif, semakin rendahnya; Ini adalah kecenderungan Anda.
Persamaan berikut menggambarkan contoh:
Na (g) => na+(g) + e-
Yang diperlukan untuk mencapai ini tidak begitu besar dibandingkan dengan ionisasi kedua:
Na+(g) => na2+(g) + e-
Sejak di na+ muatan positif mendominasi dan ion lebih kecil dari atom netral. Akibatnya, inti Na+ menarik dengan kekuatan yang jauh lebih besar untuk elektron, jadi membutuhkan yang jauh lebih besar.
-Afinitas elektronik
Dan akhirnya, ada sifat berkala dari afinitas elektronik. Ini adalah tren energi yang memiliki atom elemen fase gas untuk menerima elektron. Jika atomnya kecil dan memiliki inti dengan kekuatan daya tarik yang besar, akan mudah bagi Anda untuk menerima elektron, membentuk anion yang stabil.
Semakin stabil anion sehubungan dengan atom netral, semakin besar afinitas elektroniknya. Namun, tolakan antara elektron yang sama juga ikut bermain.
Nitrogen, misalnya, memiliki afinitas elektronik yang lebih besar daripada oksigen. Ini karena ketiga elektron mereka 2p dihilang dan lebih sedikit mengusir satu sama lain dan elektron yang masuk; Sementara dalam oksigen, ada sepasang elektron berpasangan yang menggunakan tolakan elektronik yang lebih besar; Dan di fluoride, ada dua pasangan.
Karena alasan inilah tren afinitas elektronik dikatakan dinormalisasi dari periode ketiga dari tabel periodik.
Referensi
- Shiver & Atkins. (2008). Kimia anorganik. (Edisi keempat). MC Graw Hill.
- Whitten, Davis, Peck & Stanley. (2008). Kimia. (Edisi ke -8.). Pembelajaran Cengage.
- Prof. Ortega graciela m. (1 April 2014). Sifat periodik elemen. Warna ABC. Diperoleh dari: ABC.com.Py
- Libretteks Kimia. (7 Juni 2017). Sifat periode elemen. Pulih dari: chem.Librettexts.org
- Helmestine, Anne Marie, PH.D. (2 Januari 2019). Sifat periodik elemen. Pulih dari: thinkco.com
- Toppr. (S.F.). Sifat periode elemen. Pulih dari: toppr.com /
- Sifat Berkala Elemen: Perjalanan melintasi meja adalah perjalanan melalui kimia. [PDF]. Pulih dari: cod.Edu
- « Faktor, konsekuensi, dan contoh yang dirasakan keusangan
- Sejarah Seni Objektif, Karakteristik, Perwakilan dan Karya »

