Tiga poin
- 4618
- 120
- Herbert Fritsch
Apa titik tiga?
Dia Tiga poin Ini adalah istilah di bidang termodinamika yang mengacu pada suhu dan tekanan di mana ada secara bersamaan tiga fase zat dalam keadaan kesetimbangan termodinamika. Poin ini ada untuk semua zat, meskipun kondisi di mana mereka dicapai sangat bervariasi di antara masing -masing.
Titik tiga juga dapat melibatkan lebih dari satu fase dari jenis yang sama untuk zat tertentu; yaitu, dua fase padat, cairan atau gas yang berbeda diamati. Helium, khususnya isotop helio-4-nya, adalah contoh yang baik dari titik tiga yang melibatkan dua fase cairan individu: cairan normal dan berlebihan.
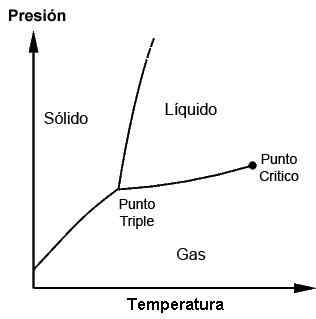
 Diagram fase menunjukkan titik tiga dan titik kritis
Diagram fase menunjukkan titik tiga dan titik kritis Untuk apa dan saat triple point digunakan?
Titik tiga air digunakan untuk menentukan kelvin, unit basis suhu termodinamika dalam sistem unit internasional (SI). Nilai ini ditetapkan menurut definisi alih -alih mengukur.
Titik tiga dari masing -masing zat dapat diamati dengan penggunaan diagram fase, yang merupakan grafik yang diplot yang memungkinkan menunjukkan kondisi pembatas dari fase gas, cair, gas (dan lainnya, dalam kasus khusus) dari suatu zat sementara mereka memberikan perubahan dalam suhu, tekanan dan/atau kelarutan.
Suatu zat dapat ditemukan di titik lelehnya di mana padatan memenuhi cairan; Itu juga dapat ditemukan pada titik didih di mana cairan memenuhi gas. Namun, itu berada di titik tiga di mana tiga fase tercapai. Diagram ini akan berbeda untuk setiap zat, seperti yang akan dilihat nanti.
Dapat melayani Anda: gravitasi API: skala dan klasifikasi minyak mentahTitik tiga dapat digunakan secara efektif dalam kalibrasi termometer, menggunakan triple point cell.
Ini adalah sampel zat dalam kondisi terisolasi (dalam "sel" kaca) yang berada pada titik tiga dengan suhu dan kondisi tekanan yang diketahui, dan dengan demikian memfasilitasi studi tentang ketepatan pengukuran termometer.
Studi konsep ini dalam eksplorasi planet Mars juga telah digunakan, di mana permukaan laut dicoba selama misi yang dilakukan pada tahun 1970 -an.
Air tiga
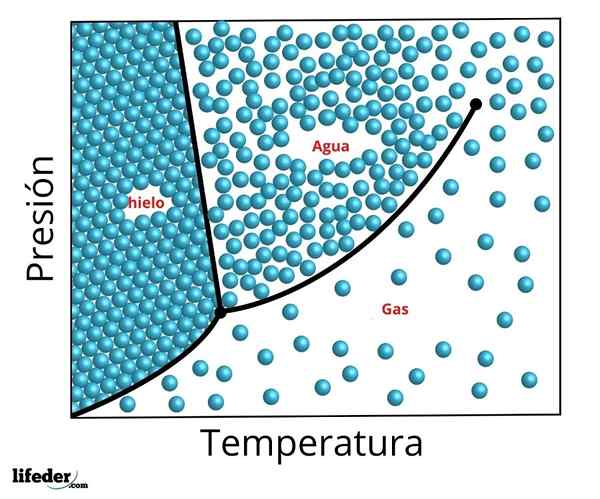 Diagram fase dari titik tiga air. Titik tiga adalah titik bawah dan kritikus titik atas
Diagram fase dari titik tiga air. Titik tiga adalah titik bawah dan kritikus titik atas The precise conditions of pressure and temperature at which water coexists in its three phases in equilibrium - liquid water, ice and steam - occur at a temperature of exactly 273.16 k (0.01 ºC) and a partial pressure of vapor of vapor 611,656 pascals (0.00603659 ATM ).
Pada titik ini dimungkinkan untuk mengubah zat menjadi salah satu dari tiga fase dengan perubahan minimal dalam suhu atau tekanannya. Bahkan ketika tekanan sistem total dapat ditempatkan di atas yang diperlukan untuk triple point, jika tekanan uap parsial berada pada 611.656 pa, sistem akan mencapai titik tiga dengan cara yang sama.
Dimungkinkan untuk mengamati pada gambar sebelumnya representasi titik tiga (atau Tiga poin, dalam bahasa Inggris) dari suatu zat yang diagramnya mirip dengan air, sesuai dengan suhu dan tekanan yang diperlukan untuk mencapai nilai ini.
Dalam kasus air, titik ini sesuai dengan tekanan minimum di mana air cair dapat ada. Untuk menekan minor ke titik tiga ini (misalnya, dalam ruang hampa) dan ketika pemanasan tekanan konstan digunakan, es padat akan dikonversi langsung menjadi uap air tanpa melalui cairan; Ini adalah proses yang disebut sublimasi.
Itu dapat melayani Anda: Teori Big Bang: Karakteristik, Tahapan, Bukti, MasalahDi luar tekanan minimum ini (pTp), es pertama -tama akan meleleh untuk membentuk air cair, dan hanya di sana yang akan menguap atau mendidih untuk membentuk uap.
Untuk banyak zat nilai suhu pada titik tiga adalah suhu minimum di mana fase cair dapat ada, tetapi ini tidak terjadi dalam kasus air. Untuk air ini tidak terjadi, karena titik pencairan es berkurang berdasarkan tekanan, seperti yang ditunjukkan dengan garis putus -putus hijau dari gambar sebelumnya.
Dalam fase bertekanan tinggi, air memiliki diagram fase yang cukup kompleks, yang menunjukkan lima belas fase es yang diketahui (pada suhu dan tekanan yang berbeda), di samping sepuluh titik tiga berbeda yang ditampilkan pada gambar berikut:
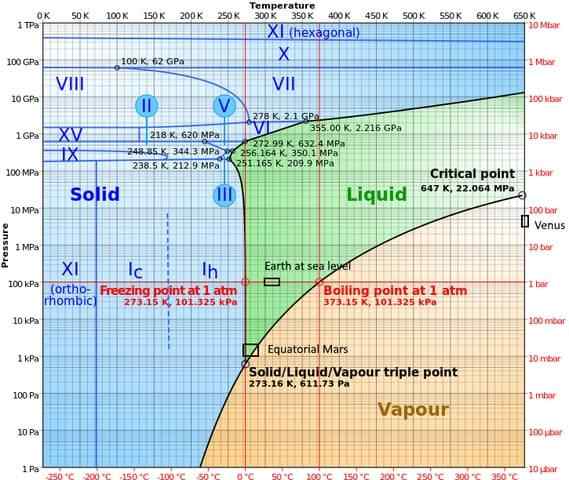
Dapat dicatat bahwa, dalam kondisi tekanan tinggi, es dapat ada seimbang dengan cairan; Diagram menunjukkan bahwa titik merger meningkat dengan tekanan. Pada suhu konstan rendah dan tekanan yang meningkat, uap dapat diubah langsung ke es, tanpa melalui fase cair.
Kondisi berbeda yang terjadi di planet -planet di mana titik tiga (darat di laut dan di daerah khatulistiwa Mars) juga diwakili dalam diagram ini).
Diagram memperjelas bahwa titik tiga bervariasi tergantung pada lokasi karena alasan tekanan dan suhu atmosfer, dan tidak hanya dengan intervensi eksperimen.
Titik tiga sikloheksana
Cyclohexan adalah siklocano yang memiliki formula molekul C6H12. Substansi ini memiliki kekhasan kondisi triple point yang dapat dengan mudah direproduksi, seperti dalam kasus air, karena titik ini terletak pada suhu 279,47 K dan tekanan 5.388 kPa.
Itu dapat melayani Anda: Tuduhan Langsung: Konsep, Karakteristik, ContohDi bawah kondisi ini, senyawa hirar, pemadatan dan peleburan dengan perubahan minimal suhu dan tekanan telah diamati.
Triple Benzene Point
Dalam kasus yang mirip dengan sikloheksan, benzena (senyawa organik dengan formula kimia C6H6) telah dengan mudah direproduksi kondisi triple point di laboratorium.
Nilai -nilainya adalah 278,5 K dan 4,83 kPa, jadi eksperimen dengan tingkat pemula ini juga umum.
Referensi
- Wikipedia. (S.F.). Wikipedia. Diperoleh dari dalam.Wikipedia.org
- Britannica, e. (1998). Encyclopedia Britannica. Diperoleh dari Britannica.com
- Kekuatan, n. (S.F.). POWER NUCLEAR. Diperoleh dari tenaga nuklir.bersih
- Wagner, w., Saul, a., & Prub, untuk. (1992). Persamaan internasional untuk tekanan di sepanjang pencairan dan di sepanjang kurva sublimasi air biasa. Bochum.
- Penoncello, s. G., Jacobsen, r. T., & Goodwin, a. R. (sembilan belas sembilan puluh lima). Untuk formulasi properti termodinamika untuk sikloheksana.

