Apa itu periodisitas kimia?
- 4605
- 1382
- Frederick Pfeffer
Itu Periodisitas kimia Ini adalah tren atau pola yang menunjukkan elemen kimia untuk satu set sifat kimia dan fisiknya. Ini menjadi semacam kekerabatan, yang merupakan panduan mendasar bagi orang tua kimia untuk mengatur dan mengklasifikasikan semua elemen dalam tabel periodik yang diketahui saat ini.
118 elemen yang ada (antara alami dan buatan) tetap, pada tingkat yang berbeda, hubungan satu sama lain yang mendefinisikan mereka dalam keluarga atau kelompok. Pada awalnya ini memungkinkan untuk menggambarkan reaktivitas elemen, serta jenis senyawa yang terbentuk; Dan bahkan lebih baik, memprediksi sifat -sifat mereka yang belum ditemukan.
 Elemen tabel periodik
Elemen tabel periodik Kemudian, sementara abad kedua puluh dan fisika berkembang, sifat -sifat ini berkorelasi dengan struktur elektronik atom. Dengan demikian, elektron menandai periodisitas kimia sehubungan dengan unsur -unsur, tetapi tidak terlalu banyak untuk isotop dan stabilitas relatifnya.
Berkat periodisitas kimia dimungkinkan untuk memahami mengapa elemen diposisikan dalam kelompok yang sama dalam tabel periodik. Ini juga memungkinkan prediksi sifat kimia, dan bahkan fisik, di antara unsur -unsur massa atom yang berbeda.
[TOC]
Pola dan kelompok
 Seperti pola zigzag dari awan -awan ini, sifat -sifat elemen menunjukkan kecenderungan berkala dan khas. Sumber: Pravin Bagga/CC BYS-S (https: // CreativeCommons.Org/lisensi/by-sa/3.0)
Seperti pola zigzag dari awan -awan ini, sifat -sifat elemen menunjukkan kecenderungan berkala dan khas. Sumber: Pravin Bagga/CC BYS-S (https: // CreativeCommons.Org/lisensi/by-sa/3.0) Periodisitas kimia diamati, seperti yang diharapkan, dalam sifat periodik. Ini ditandai dengan kecenderungan nilai -nilai mereka saat mereka dievaluasi selama periode atau kelompok periodik.
Zigzag, gergaji atau gunung yang curam dapat dipilih untuk tujuan perbandingan: dengan pasang surut. Yaitu, rentang sifat periodik memiliki minimal dan maksimum untuk elemen tertentu. Dan posisi relatif dari elemen -elemen ini sesuai, dengan cemerlang, dengan lokasi dalam kelompok masing -masing.
Itulah sebabnya periodisitas kimia berguna untuk menganalisisnya berdasarkan kelompok; Namun, periode sangat penting untuk visi yang lengkap tentang tren.
Dapat melayani Anda: kalium karbonat (k2co3): struktur, sifat, penggunaan, mendapatkanIni akan terlihat dengan contoh -contoh periodisitas dalam kimia berikut, yang tidak hanya mendapatkan keuntungan dalam sifat periodik, tetapi juga dalam senyawa anorganik dan, inklusif, organik.
Energi ionisasi
Energi ionisasi, adalah salah satu sifat periodik yang paling menonjol. Semakin besar atom suatu elemen, semakin mudah salah satu elektron terakhirnya adalah melepas; yaitu, Valencia. Oleh karena itu: atom dengan radio kecil akan memiliki besar, sedangkan atom dengan radio besar, mereka akan memiliki kecil.
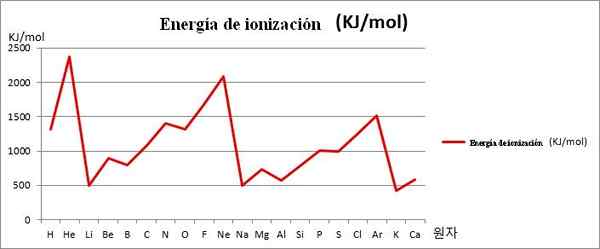 EI vs. Grafik. 20 elemen kimia pertama. Sumber: Kenneth.JH.Han/cc by-sa (https: // createveCommons.Org/lisensi/by-sa/3.0)
EI vs. Grafik. 20 elemen kimia pertama. Sumber: Kenneth.JH.Han/cc by-sa (https: // createveCommons.Org/lisensi/by-sa/3.0) Catatan misalnya dalam gambar di atas bahwa elemen Li, Na dan K, memiliki anak di bawah umur, itulah sebabnya mereka terletak di lembah atau dana grafik. Sementara itu, unsur -unsur yang dia, ne dan ar, ditemukan di puncak atau titik yang lebih tinggi, karena mereka sangat besar dalam kaitannya dengan elemen lainnya.
Unsur -unsur Li, Na dan K termasuk dalam kelompok logam alkali, ditandai dengan korban EI mereka. Di sisi lain, unsur -unsur yang ia, ne dan ar sesuai dengan gas mulia, dengan sangat tinggi, karena atom mereka adalah yang terkecil di antara semua elemen untuk periode yang sama dari tabel periodik.
Dengan demikian, periodisitas kimia menunjukkan bahwa itu mengurangi kelompok, tetapi meningkatkan tur periode dari kiri ke kanan.
Blok Hydros P
Contoh periodisitas kimia di luar sifat periodik yang kita lihat di hidror elemen blok P.
Misalnya, kelompok 15 terdiri dari elemen n, p, as, sb dan bi. Jika diketahui bahwa amonia, NH3, Ini memiliki nitrogen dengan jumlah oksidasi +3, maka dimungkinkan untuk diharapkan, dengan periodisitas sederhana, bahwa elemen yang tersisa juga memiliki hidro yang serupa. Dan memang itu: NH3, Ph3, Abu3, SBH3 dan BIH3.
Dapat melayani Anda: Boron: Sejarah, Properti, Struktur, PenggunaanKasus serupa lainnya terjadi dengan kelompok 16. Oksigen hidrida adalah h2Atau, air. Diharapkan, sekali lagi, bahwa elemen S, SE, TE dan PO memiliki hidror dengan rumus yang sama, tetapi dengan sifat yang sangat berbeda. Dan itu: h2SH2SE, h2Te dan h2PO. Ini karena periodisitas kimia.
Mungkin contoh yang paling mengesankan dipahami oleh karbon, silikon, dan germanium hydros. Karbon hidrida adalah cho4, Dan silikon, sih4. Germanio, diprediksi oleh Mendeleev dengan nama Eka-silicio (ES), harus memiliki periodisitas hidrida dengan formula GEH4; prediksi yang akhirnya mengkonfirmasi setelah penemuannya dan studi selanjutnya.
Molekul halogen
Jika diketahui bahwa fluoride dalam keadaan dasar sebagai molekul M2, Kemudian diasumsikan bahwa halogen lainnya (CL, BR, I dan AT) juga membentuk molekul diatomik. Dan itu adalah, menjadi molekul CL2, Br2 dan saya2 Yang paling terkenal.
Oksida dan sulfida
Demikian pula seperti yang disebutkan dengan blok hidror P, Oksida dan sulfida untuk unsur -unsur kelompok yang sama menunjukkan semacam korespondensi dalam formula kimianya masing -masing. Misalnya, lithium oksida adalah li2Atau, menjadi oksida untuk logam alkali lain atau kelompok 1: na2OKE2Atau, RB2O dan CS2SALAH SATU.
Ini karena dalam semua dari mereka logam dengan jumlah oksidasi +1, berinteraksi dengan anion atau2-. Hal yang sama terjadi dengan sulfida mereka: li2S, na2S, dll. Dalam kasus logam alkalinoterro atau kelompok 2, formula oksida dan sulfida mereka, masing -masing: lebah dan BES, mgo dan mgs, cao dan cas, sro dan srs, bao dan bas.
Itu dapat melayani Anda: asam selenary (h2so3): sifat, risiko dan penggunaanPeriodisitas ini juga berlaku (sebagian) untuk oksida elemen blok P: Co2, Sio2, Geo2, B2SALAH SATU3, Ke2SALAH SATU3, Ga2SALAH SATU3, dll. Namun, untuk elemen blok D atau orang lain dari blok itu P, Periodisitas ini menjadi lebih rumit karena bilangan oksidasi setinggi mungkin untuk elemen yang sama.
Misalnya, tembaga dan perak termasuk dalam kelompok 11. Satu memiliki dua oksida: cuo (cu2+) dan cu2Atau (cu+); Sementara yang lain hampir tidak memiliki satu: lalu (AG+).
Hidrokarbon dan Silan
Baik karbon dan silikon memiliki kemampuan untuk membentuk ikatan C-C atau Si-Si, masing-masing. Ikatan C-C jauh lebih stabil, sehingga struktur hidrokarbon dapat menjadi lebih banyak lebih banyak dan bervariasi daripada rekan-rekan lajang mereka.
Kesimpulan ini disebabkan lagi oleh periodisitas kimia. Misalnya, Ethane, Cho3Ch3 atau c2H6 Disilanum memiliki mitranya, SIH3Ya h3 atau jika2H6.
Referensi
- Whitten, Davis, Peck & Stanley. (2008). Kimia. (Edisi ke -8.). Pembelajaran Cengage.
- Shiver & Atkins. (2008). Kimia anorganik. (Edisi keempat). MC Graw Hill.
- Helmestine, Anne Marie, PH.D. (26 Agustus 2020). Definisi periody dalam kimia. Pulih dari: thinkco.com
- DAN. V. Babaev, & Ray Hefferlin. (S.F.). Konsep periodisitas kimia:
Dari pola hiper-periodisitas tabel molekul Mendeleev. Pulih dari: chem.MSU.Ru - Bunga hlm., Theopold k., & Langley r. (S.F.). Periody. Libretteks Kimia. Pulih dari: chem.Librettexts.org
- Universitas Terbuka. (2020). Pola kimia dapat ditemukan pada tabel periode: periodisitas kimia. Pulih dari: terbuka.Edu
- « Konsep dan contoh keseimbangan yang stabil
- Sejarah Sosiologi Pedesaan, bidang studi, kepentingan »

