Apa proses isotermal? (Contoh, latihan)

- 2361
- 109
- Frederick Pfeffer
Dia proses isotermal atau isoterm adalah proses termodinamika reversibel di mana suhu tetap konstan. Dalam gas, ada situasi di mana perubahan dalam sistem tidak menghasilkan variasi suhu, tetapi dalam karakteristik fisik.
Perubahan ini adalah perubahan fase, ketika zat berubah dari padatan ke cairan, cairan gas atau sebaliknya. Dalam kasus seperti itu, molekul zat menyesuaikan posisinya, menambahkan atau mengekstraksi energi termal.
 Gambar 1. Carambans yang meleleh adalah contoh dari proses isotermal. Sumber: Pixabay.
Gambar 1. Carambans yang meleleh adalah contoh dari proses isotermal. Sumber: Pixabay. Energi termal yang diperlukan untuk perubahan fase terjadi dalam suatu zat disebut panas laten atau panas transformasi.
Salah satu cara untuk mendapatkan proses isotermal adalah dengan menghubungi zat yang akan menjadi sistem yang diteliti dengan deposit termal eksternal, yang merupakan sistem kapasitas kalori besar lainnya. Dengan cara ini, pertukaran panas yang lambat terjadi, bahwa suhunya tetap konstan.
Jenis proses ini sering diberikan di alam. Misalnya, pada manusia ketika suhu tubuh meningkat atau turun kita merasa sakit, karena dalam tubuh kita banyak reaksi kimia yang mempertahankan kehidupan diberikan pada suhu konstan. Ini berlaku untuk darah panas secara umum.
Contoh lainnya adalah es yang meleleh dengan panas saat musim semi dan es tiba.
[TOC]
Contoh proses isotermal
-Metabolisme Hewan Panas dilakukan pada suhu konstan.
 Gambar 2. Hewan berdarah panas memiliki mekanisme untuk menjaga suhu tetap konstan. Sumber: Wikimedia Commons.
Gambar 2. Hewan berdarah panas memiliki mekanisme untuk menjaga suhu tetap konstan. Sumber: Wikimedia Commons. -Ketika air mendidih, perubahan fase terjadi, cairan gas, dan suhunya tetap konstan pada sekitar 100 º C, karena faktor -faktor lain dapat mempengaruhi nilainya.
-Es yang meleleh adalah proses isotermal lain yang sering, serta menempatkan air di dalam freezer untuk membuat es batu.
Dapat melayani Anda: Optik Geometris: Studi, Hukum, Aplikasi, Latihan Apa-Mesin mobil, lemari es, serta banyak jenis mesin lainnya, beroperasi dengan benar dalam kisaran suhu tertentu. Untuk mempertahankan suhu yang sesuai, perangkat yang disebut Termostat. Dalam desainnya, berbagai prinsip operasi digunakan.
Siklus Carnot
Mesin Carnot adalah mesin yang ideal dari mana pekerjaan diperoleh berkat proses yang sepenuhnya reversibel. Ini adalah mesin yang ideal karena tidak mempertimbangkan proses yang menghilangkan energi, sebagai viskositas zat yang melakukan pekerjaan, atau gesekan.
Siklus Carnot terdiri dari empat tahap, dua di antaranya justru isotermal dan dua adiabatik lainnya. Tahap isotermal adalah kompresi dan perluasan gas yang bertanggung jawab untuk menghasilkan pekerjaan yang bermanfaat.
Mesin mobil beroperasi dengan prinsip yang sama. Pergerakan piston di dalam silinder ditransmisikan ke bagian lain dari mobil dan menghasilkan gerakan. Itu tidak memiliki perilaku sistem yang ideal seperti mesin Carnot, tetapi prinsip -prinsip termodinamika adalah umum.
Perhitungan pekerjaan yang dilakukan dalam proses isotermal
Untuk menghitung pekerjaan yang dilakukan oleh suatu sistem ketika suhu konstan, hukum termodinamika pertama harus digunakan, yang menyatakan:
ΔU = q - w
Ini adalah cara lain untuk mengekspresikan konservasi energi dalam sistem, disajikan melalui ΔU atau perubahan energi, Q saat panas disediakan dan akhirnya W, yang merupakan pekerjaan yang dilakukan oleh sistem tersebut.
Misalkan sistem tersebut adalah gas ideal yang terkandung dalam silinder piston area seluler KE, Apa yang berhasil saat volumenya V perubahan V1 ke V2.
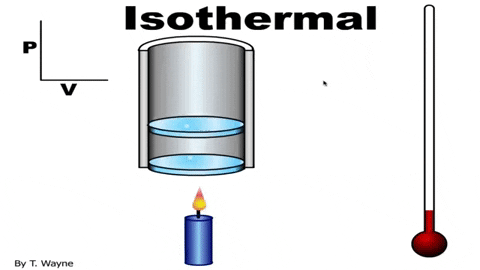 Gambar 3. Dalam proses isotermal, gas mengembang di piston tanpa mengubah suhu. Sumber: YouTube.
Gambar 3. Dalam proses isotermal, gas mengembang di piston tanpa mengubah suhu. Sumber: YouTube. Persamaan status gas yang ideal adalah PV = NRT, yang menghubungkan volume dengan tekanan P dan suhunya T. Nilai N dan R konstan: N adalah jumlah mol gas dan r konstanta gas. Dalam kasus proses isotermal produk Pv itu konstan.
Dapat melayani Anda: Konstanta Antoine: Rumus, Persamaan, ContohNah, pekerjaan yang dilakukan dihitung dengan mengintegrasikan pekerjaan diferensial kecil, di mana kekuatan F menghasilkan perpindahan DX kecil:
Dw = fdx = padx
Sebagai ADX justru variasi volume Dv, Jadi:
DW = PDV
Untuk mendapatkan pekerjaan total dalam proses isotermal, ekspresi DW terintegrasi:
Tekanan P dan volume V Mereka adalah grafik dalam diagram P-v seperti yang ditunjukkan pada gambar dan pekerjaan yang dilakukan setara dengan area di bawah kurva:
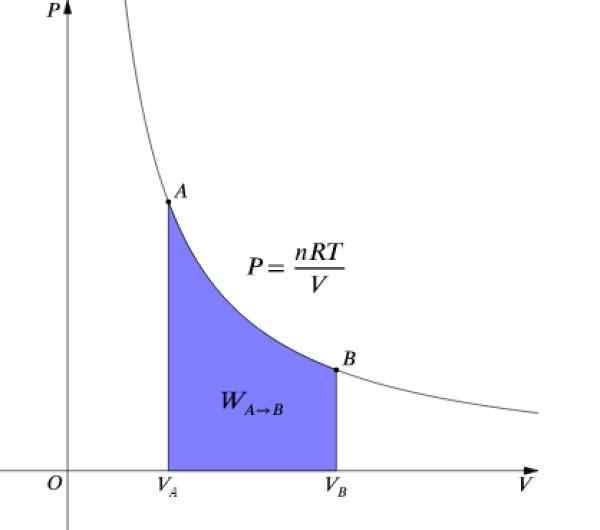 Gambar 4. Diagram P-V dari proses isotermal. Sumber: Wikimedia Commons.
Gambar 4. Diagram P-V dari proses isotermal. Sumber: Wikimedia Commons. Sebagai ΔU = 0 Karena suhunya tetap konstan, dalam proses isotermal itu harus:
Q = w
- Latihan 1
Silinder yang disediakan dengan piston seluler berisi gas ideal pada 127 ºC. Jika piston bergerak sampai volume awal berkurang 10 kali, menjaga suhu tetap konstan, temukan jumlah mol yang terkandung dalam silinder, jika pekerjaan yang dilakukan pada gas adalah 38.180 J.
Fakta: R = 8.3 J/mol. K
Larutan
Pernyataan itu menegaskan bahwa suhunya tetap konstan, maka kita berada di hadapan proses isotermal. Untuk pekerjaan yang dilakukan pada gas Anda memiliki persamaan yang sebelumnya dikurangkan:

127 º C = 127 + 273 K = 400 K
N jelas, jumlah tahi lalat:
N = w / rt ln (v2 / v1) = -38180 j / 8.3 J/mol.K x 400 k x ln (v2/10v2) = 5 mol
Tanda negatif adalah sebelum bekerja. Pembaca yang penuh perhatian akan memperhatikan di bagian sebelumnya bahwa W didefinisikan sebagai "pekerjaan yang dilakukan oleh sistem" dan memiliki tanda +. Jadi "pekerjaan yang dilakukan pada sistem" memiliki tanda negatif.
Itu dapat melayani Anda: Kondisi keseimbangan kedua: penjelasan, contoh, latihan- Latihan 2
Anda memiliki udara dalam silinder yang dilengkapi dengan plunger. Awalnya ada 0.4 m3 tekanan pada suhu 100 kPa dan 80 º C. Udara dikompresi pada 0.1 m3 memastikan bahwa suhu di dalam silinder tetap konstan selama proses.
Tentukan berapa banyak pekerjaan yang dilakukan selama proses ini.
Larutan
Kami menggunakan persamaan untuk pekerjaan yang sebelumnya dikurangkan, tetapi jumlah tahi lalat tidak diketahui, yang dapat dihitung dengan persamaan gas ideal:
80 º C = 80 + 273 K = 353 K.
P1V1 = n.R.T → n = p1V1 /Rt = 100000 pa x 0.4 m3 /8.3 J/mol. K x 353 k = 13.65 mol
W = n.R.T ln (v2/V1) = 13.65 mol x 8.3 J/mol. K x 353 k x ln (0.1/0.4) = -55.442.26 J
Sekali lagi tanda negatif menunjukkan bahwa pekerjaan dilakukan pada sistem, yang selalu terjadi saat gas dikompresi.
Referensi
- Bauer, w. 2011. Fisika untuk Teknik dan Ilmu Pengetahuan. Volume 1. MC Graw Hill.
- Cengel, dan. 2012. Termodinamika. 7ma Edisi. Bukit McGraw.
- Figueroa, d. (2005). Seri: Fisika untuk Sains dan Teknik. Volume 4. Cairan dan termodinamika. Diedit oleh Douglas Figueroa (USB).
- Knight, r. 2017. Fisika untuk Ilmuwan dan Teknik: Pendekatan Strategi.
- Serway, r., Vulle, c. 2011. Dasar -dasar fisika. 9na Pembelajaran Cengage.
- Wikipedia. Proses isotermal. Diperoleh dari: di.Wikipedia.org.
- « Struktur akrilonitril, sifat, produksi, penggunaan
- Kalimat berturut -turut apa itu dan 75 contoh »


