Jenis reaksi sintesis, faktor, contoh
- 5057
- 1520
- Frederick Pfeffer
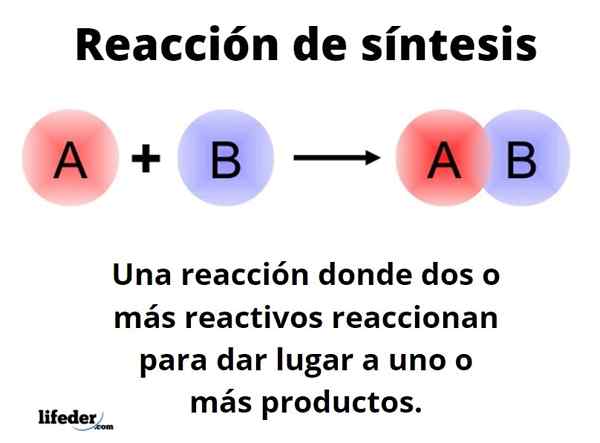
Itu Reaksi sintesis Ini adalah satu di mana dua atau lebih reagen bereaksi untuk dapat berasal, secara kuantitatif, satu atau lebih produk, baik di laboratorium atau tingkat industri. Ini adalah salah satu reaksi kimia yang paling mendasar, dan jenis dan desainnya hampir tak terbatas.
Cara generik dapat diwakili dengan formulir: a+b → c. Dalam reaksi sintesis sederhana, reagen untuk bereaksi dengan reagen B lain, untuk menghasilkan produk C. Dikatakan bahwa itu terdiri dari satu langkah. Namun, mungkin terjadi bahwa untuk bereaksi terlebih dahulu dengan E, diikuti oleh F, dan akhirnya dengan G (reagen lain), untuk berubah menjadi produk C; yaitu, reaksi yang sama terjadi dalam beberapa langkah.

Terlepas dari satu langkah atau banyak, semua reaksi sintesis didasarkan pada efektivitas (termodinamika dan kinetik) yang dengannya reagen bereaksi untuk berubah menjadi produk, serta kinerja eksperimental. Diinginkan bahwa reaksi sintesis berhasil berlalu dan menghasilkan produk sebanyak mungkin.
[TOC]
Jenis reaksi sintesis
Sederhana atau ganda
Reaksi sintesis tidak sepenuhnya mudah diklasifikasikan. Ini bisa menjadi masalah yang terkait dengan kriteria ahli kimia. Karena? Misalkan banyak reaksi yang dikomentari di atas:
A + e → p1
P1 + F → p2
P2 + G → c
Menjadi p1 Dan p2 perantara yang tidak menarik. Reaksi sintesis produk atau senyawa C, mulai dari A sebagai reagen utama (membatasi atau membatasi reagen), adalah beberapa atau kompleks, karena terjadi dalam beberapa langkah, di mana reagen lain berpartisipasi: e, f dan g dan g.
Masing -masing dari tiga reaksi sebelumnya dapat terdiri dan jenis reaksi kimia dalam diri mereka sendiri. Artinya, reaksi sintesis dapat berupa jenis reaksi kimia lainnya (perpindahan ganda, redoks, pembakaran, netralisasi, nitrasi, substitusi, dll.), selama suatu produk berasal dan memiliki kinerja eksperimental yang terkait.
Jadi:
A + e → p1
Dapat dilihat sebagai reaksi sintesis sederhana untuk produk p1, terlepas dari jenis reaksi. Dan juga:
P1 + F → p2
Ini adalah reaksi sintesis sederhana lainnya untuk produk p2.
Anorganik atau organik
Reaksi sintesis dapat berupa apa pun sehubungan dengan sifat reaksi dan mekanisme molekulernya. Namun, ini dapat dibagi sesuai dengan sifat kimia reagen dan produk.
Dapat melayani Anda: natrium asetat: struktur, sifat, sintesis, penggunaanMisalnya, jika reagen adalah zat anorganik, maka kita berbicara tentang sintesis anorganik; Sedangkan jika mereka adalah zat organik, kami sudah akan berbicara tentang sintesis organik.
Bidang sintesis organik sangat kolosal, karena mencakup produksi obat, pewarna, plastik, insektisida, perekat, parfum, pengawet, di antara ribuan produk lain.
Faktor yang terlibat dalam reaksi sintesis
Faktor -faktor yang terlibat dalam reaksi sintesis adalah semua parameter atau variabel, fisik dan kimia, yang secara langsung mempengaruhi kinerja reaksi dan kualitas produk yang berasal. Beberapa dari mereka adalah sebagai berikut:
Suhu
Suhu sangat penting dalam reaksi sintesis apa pun. Tergantung pada termodinamika Anda, mungkin lebih mudah untuk tetap rendah atau tinggi. Demikian juga, ada rentang suhu di mana reaksi lateral yang tidak diinginkan mungkin, jadi penting untuk mengendalikannya dan memverifikasi setiap saat.
Waktu
Waktu juga penting dalam reaksi sintesis, karena harus memastikan bahwa itu cukup untuk menjamin pembentukan keseimbangan. Setelah jumlah waktu tertentu, lebih banyak produk akan berhenti diperoleh, dan saat itulah diputuskan untuk menghentikan sintesis sepenuhnya.
Konsentrasi dan kualitas reagen
Semakin terkonsentrasi reagen, semakin cepat reaksi. Namun, juga penting untuk lebih jelas tentang proporsi konsentrasinya, serta besarnya, karena perubahan minimum akan mempengaruhi kinerja akhir.
Di sisi lain, reagen harus semurni mungkin, jika tidak konsentrasi yang keliru akan diasumsikan; Atau lebih buruk lagi, produk akan terkontaminasi, atau reaksi yang tidak diinginkan akan terjadi.
Agitasi
Cara media reaksi diaduk akan mempengaruhi rapides reaksi sintesis.
Tekanan
Tekanan, seperti konsentrasi, memainkan peran penting, terutama ketika reagen adalah spesies atau zat soda. Semakin besar tekanan, semakin besar tabrakan atau interaksi antara reagen dan, oleh karena itu, akan ada lebih mungkin untuk bereaksi.
ph
PH (asam atau basa) secara langsung mempengaruhi mekanisme reaksi, sehingga merupakan faktor kunci dalam mendefinisikan produk mana yang akan diperoleh pada akhir sintesis.
Dapat melayani Anda: titik didih: konsep, perhitungan, dan contohKatalis
Katalis adalah zat yang mempercepat reaksi kimia tetapi tanpa dikonsumsi selama proses. Ada sintesis bahwa tanpa intervensi Anda tidak mungkin.
Contoh reaksi sintesis
Selanjutnya, dan akhirnya, persamaan kimia untuk reaksi sintesis dari beberapa senyawa akan dikutip.
Garam meja (natrium klorida)
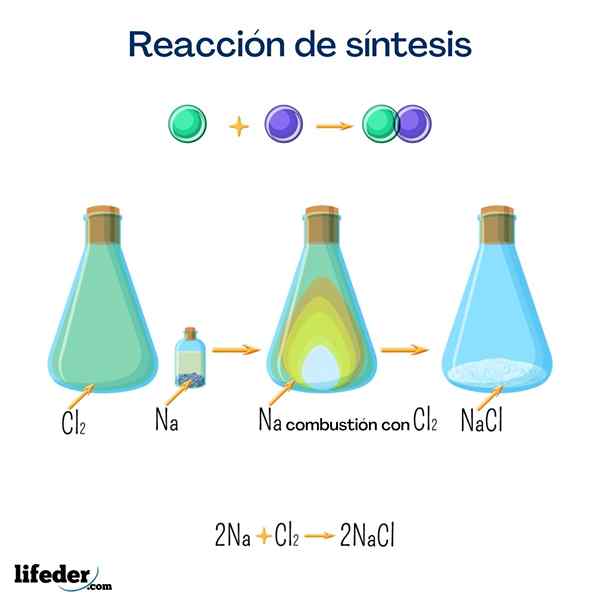
Garam ini adalah salah satu yang paling dikenal oleh semua untuk penggunaan domestiknya. Itu diperoleh dari natrium dan klorin, dan meskipun dapat diperoleh dengan reaksi berikut, sangat mudah untuk menemukannya secara alami.
2 Na+Cl 2 → 2 NaClGlukosa
Ini adalah salah satu reaksi terpenting bagi kehidupan untuk ada seperti yang kita kenal. Tanaman menggunakan karbon dioksida dan lingkungan lingkungan dengan sinar matahari untuk menghasilkan glukosa dan oksigen.
Reaksi dengan cara yang sangat umum dapat dilihat di bawah ini, tetapi penting untuk dipahami bahwa di baliknya ada beberapa reaksi dan mekanisme untuk hal ini menjadi mungkin.
6CO2 + 6H2O → C6H12O6 + O2
Sakarosa
Reaksi sintesis ini terjadi pada organisme hidup dan diberikan saat polimerisasi glukosa dengan fruktosa. Karena strukturnya, kedua molekul ini berinteraksi dan hasil akhirnya adalah sukrosa dan air, seperti yang dapat dilihat dalam persamaan berikut:
C6H12O6 + C6H12O6 → C12H22O11 + H2O
Amonia
3 h2(g) + n2(g) → 2 nh3(G)
Reagen h2 dan N2 Mereka gas. Tekanan harus tinggi untuk molekul Anda bereaksi dan berasal dari amonia, NH3. Ini adalah salah satu reaksi sintesis terpenting dari kimia industri.
Air
2 h2(g) + atau2(g) → 2 jam2O (g)
H2 SAYA2 bereaksi eksotermik untuk menghasilkan uap air. Jumlah energi yang dilepaskan sedemikian rupa sehingga hidrogen adalah salah satu bahan bakar yang paling menjanjikan dalam aplikasi kedirgantaraan.
Alkohol
C2H4(g) + h2Atau (l) → cho3Ch2Oh (l)
Etanol dikenal sebagai alkohol, hanya menjadi salah satu dari banyak alkohol yang ada. Reaksi sintesisnya terdiri dari hidrasi etilen, c2H4 atau h2C = ch2, di mana molekul air ditambahkan ke ikatan rangkapnya.
Asam sulfat
Asam sulfat memiliki beberapa rute sintetis yang efisien. Namun, yang paling sederhana terdiri dari beberapa langkah:
Dapat melayani Anda: carboxymethylcelluloseS (S) +O2(g) → begitu2(G)
2 Jadi2(g)+atau2(g) ⇌ 2 Jadi3(G)
Sw3(g)+h2Atau (l) → h2Sw4(G)
H2Sw4(g) → H2Sw4(L)
Sulphur terbakar dengan oksigen berlebih untuk pertama kali berubah menjadi begitu2, Dan kemudian dengan demikian3. Lalu begitu3 terhidrasi untuk menghasilkan uap H2Sw4, yang akhirnya mengembun di h2Sw4 cairan. Sintesis ini sangat penting, sehingga dengan sendirinya menunjukkan seberapa kuat.
Metanol
Co (g) + 2 jam2(g) → ch3Oh (l)
Gas CO dan H2 bereaksi dan mengembun pada katalis logam untuk menimbulkan metanol, alkohol paling sederhana dari semuanya.
Magnesium sulfat
Itu dapat terjadi dari reaksi yang sangat sederhana yang terdiri dari magnesium dan asam sulfat. Sangat sulit untuk menemukannya di alam tanpa air.
Mg + h2so4 → h2 + mgso4
Karbon dioksida
Itu terjadi secara alami dalam beberapa proses, ketika karbon dioksida diproduksi dengan molekul karbon dioksida.
Ini hadir dalam proses alami seperti pernapasan, sebagai reagen dalam fotosintesis dan terjadi dengan mudah dalam reaksi pembakaran.
C +O2 → CO2
Asam hidroklorik
Asam klorida banyak digunakan sebagai asam murah dan sebagai zat reaktif untuk sintesis senyawa lain.
Cl2+h2 → 2hcl
Kalsium karbonat
Ia dikenal secara luas sebagai agen yang sangat berlimpah di alam, terutama di batu, mineral, dan kerang di laut. Reaksinya didasarkan pada interaksi kalsium oksida dengan karbon dioksida.
CAO +CO2 → CACO3
Referensi
- Whitten, Davis, Peck & Stanley. (2008). Kimia. (Edisi ke -8.). Pembelajaran Cengage.
- Shiver & Atkins. (2008). Kimia anorganik. (Edisi keempat). MC Graw Hill
- Graham Solomons t.W., Craig b. Fryhle. (2011). Kimia organik. (10th Edisi.). Wiley Plus.
- Carey f. (2008). Kimia organik. (Edisi Keenam). MC Graw Hill.
- Morrison dan Boyd. (1987). Kimia organik. (Edisi Kelima). Addison-Wesley Iberoamericana.
- Metler Toledo. (S.F.). Reaksi sintesis. Pulih dari: mt.com
- Helmestine, Anne Marie, PH.D. (27 Agustus 2020). Deskripsi Reaksi Sintesis Ditambah Ujian. Diperoleh dari Thoughtco.com
- Wikipedia. (2020). Sintesis Kimia. Diperoleh dari: di.Wikipedia.org
- Danielle Reid. (2020). Reaksi Sintesis: Definisi, Rumus & Contoh. Belajar. Pulih dari: belajar.com

