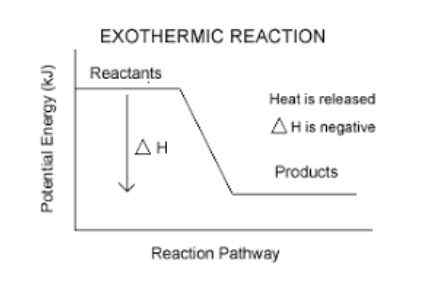
Reaksi eksotermik
- 1279
- 320
- Miss Wm Hudson
Kami menjelaskan apa reaksi eksotermik, karakteristiknya, perbedaan dengan reaksi endotermik dan memberikan beberapa contoh
Apa reaksi eksotermik?
Itu reaksi eksotermik Mereka adalah reaksi kimia yang melepaskan energi dalam bentuk panas. Kata eksotermik dibentuk oleh "Exo" yang berarti "keluar", dan "termos" yang berarti panas, jadi "reaksi eksotermik" secara harfiah berarti, reaksi di mana panas keluar.
Reaksi ini sangat umum dan kita dapat menemukannya di mana -mana, dari rumah kita ke sel yang merupakan bagian dari tubuh kita.
Di rumah kita dapat menemukannya di dapur saat gas terbakar di tanduk untuk memasak makanan kita. Kami juga menemukan mereka di dalam mesin mobil saat mereka membakar bahan bakar.
 Contoh reaksi eksotermik
Contoh reaksi eksotermik Di sisi lain, reaksi eksotermik sangat penting untuk kehidupan, karena mereka memberikan sel energi yang mereka butuhkan untuk hidup, tumbuh dan bereproduksi.
Karakteristik reaksi eksotermik
Mereka melepaskan energi dalam bentuk panas
Ini adalah karakteristik utama yang menjadikannya reaksi eksotermik.
Energi yang dilepaskan berasal dari reagen yang sama
Setiap reaksi kimia membutuhkan beberapa energi aktivasi untuk terjadi. Dalam kasus reaksi eksotermik, energi ini berasal dari reagen yang sama ketika diubah menjadi produk.
Produk reaksi eksotermik selalu lebih stabil daripada reagen.
Reagen dengan menjadi produk, kehilangan sebagian energi mereka dalam bentuk panas. Untuk alasan ini, produk selalu tetap dengan energi yang lebih sedikit daripada reagen, yang membuatnya lebih stabil.
Mereka memiliki variasi entalpi negatif.
Ini adalah cara mudah untuk mengetahui apakah reaksi eksotermik atau tidak. Reaksi apa pun yang memiliki AH (baca delta h) negatif, akan menjadi eksotermik.
- Misalnya, Reaksi pembakaran butana (gas yang kita bakar di dapur) memiliki variasi entalpi -11.823 kkal/mol. Oleh karena itu, ini adalah reaksi eksotermik.
Mereka hanya perlu pemicu untuk terjadi dalam banyak kasus.
Banyak reaksi eksotermik hanya membutuhkan sesuatu yang memberi mereka energi yang cukup untuk memulai. Setelah ini, panas yang sama yang mereka lepaskan sudah cukup untuk menjaga reaksi berjalan.
- Misalnya, Dengan membakar gas, hanya satu percikan yang diperlukan, maka nyala api terus menyala sampai gas selesai.
Perbedaan antara reaksi eksotermik dan reaksi endotermik
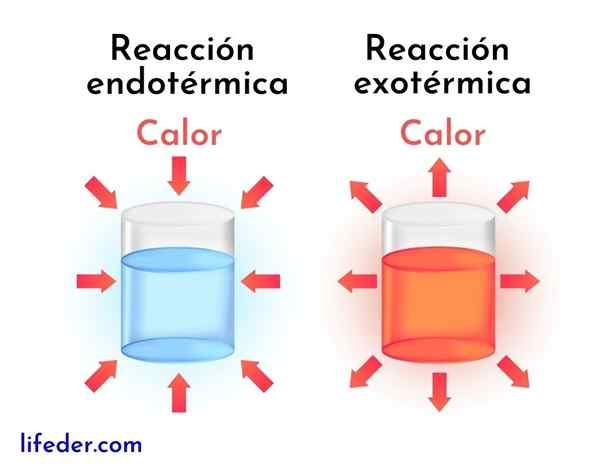
Reaksi eksotermik adalah kebalikan dari reaksi endotermik. Dalam yang terakhir, reagen menyerap energi dalam bentuk panas alih -alih melepaskannya, seperti dalam reaksi eksotermik.
Selanjutnya, perbedaan utama antara reaksi eksotermik dan endotermik disajikan:
Reaksi eksotermik | Reaksi endotermik |
Mereka melepaskan energi dalam bentuk panas. | Mereka menyerap energi dalam bentuk panas. |
Mereka memiliki variasi entalpi negatif, yaitu DH<0. | Mereka memiliki variasi entalpi yang positif, yaitu dh> 0. |
Mereka cenderung meningkatkan suhu di sekitarnya. | Mereka cenderung mengurangi suhu atau dingin. |
Energi yang membuat reaksi berjalan berasal dari reagen yang sama. | Energi yang membuat reaksi berjalan berasal dari lingkungan. |
Produk yang lebih stabil selalu diperoleh dengan lebih sedikit energi. | Produk yang kurang stabil selalu diperoleh dengan tingkat energi yang lebih tinggi. |
Contoh reaksi eksotermik
Pembakaran gas dapur
Di sebagian besar rumah di dunia, gas yang digunakan untuk memasak makanan adalah butana, yang memiliki formula molekul C4H10. Hidrokarbon ini dibakar dengan oksigen udara dengan menggunakan reaksi pembakaran berikutnya melepaskan sejumlah besar panas:
Dapat melayani Anda: mikroskop sederhana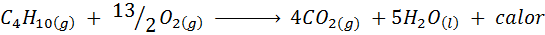
Ledakan dinamit
Dynamite berisi bahan peledak yang disebut nitrogliserin (c3H5N3SALAH SATU9). Senyawa ini terurai dengan sangat keras melepaskan panas dalam jumlah besar, yang menyebabkan ledakan besar. Reaksi kimianya adalah:
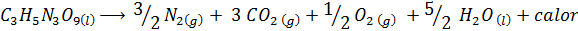
Reaksi ini memiliki a ΔH = -368 kkal⁄mol, Jadi ini adalah reaksi eksotermik.
Pembakaran spontan fosfor putih
Elemen fosfor (P) dapat ditemukan sebagai fosfor merah atau fosfor putih. Fosfor putih. Reaksinya adalah:
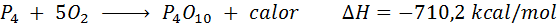
Napas seluler
Pernapasan seluler adalah reaksi kimia eksotermik yang terdiri dari oksidasi makanan yang kita makan. Panas yang dilepaskan oleh reaksi ini digunakan oleh sel untuk melakukan reaksi kimia endotermik yang tak ada habisnya yang membutuhkan energi untuk terjadi.
Kembang api
Kembang api berisi bubuk mesiu hitam sebagai komponen peledak utama. Bubuk mesiu adalah campuran yang mengandung kalium nitrat, grafit dan karbon belerang yang bereaksi satu sama lain melalui reaksi eksotermik. Panas yang dilepaskan reaksi ini, menghasilkan berbagai warna yang kita lihat di surga saat kembang api meledak.
Bantalan termal kimia
Bantalan termal digunakan sebagai kompres panas untuk meringankan cedera olahraga. Ini terdiri dari kantong tertutup yang berisi air dan seorang ahli kimia di dalam tabung kecil. Saat tabung rusak, ahli kimia dicampur dengan air yang menghasilkan reaksi kimia eksotermik yang memanaskan pad.
Reaksi natrium logam dengan air
Sodium (NA) adalah logam alkali yang sangat reaktif yang ketika bersentuhan dengan air bereaksi dengan keras melepaskan banyak panas dan hidrogen gas. Reaksinya adalah:
Itu dapat melayani Anda: metode pemisahan campuran heterogen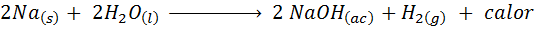
Reaksi ini melepaskan kalori 1900 untuk setiap gram Na yang bereaksi dengan air. Ini berarti bahwa 1 gram natrium sudah cukup untuk memanaskan 3 cangkir kopi sedang.
Pembubaran Deterjen
Ini adalah reaksi yang bisa dialami siapa pun di rumah mereka. Saat mengambil segenggam debu debu untuk mencuci pakaian dan membasahi dengan sedikit air, tangan akan segera terasa panas. Ini karena proses pembubaran deterjen dalam air adalah eksotermik.
Reaksi trimita
Termita adalah campuran aluminium dalam bentuk bubuk yang sangat halus dan oksida logam lain seperti besi. Setelah percikan, reaksi yang terjadi adalah:
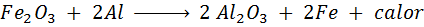
Reaksi ini melepaskan begitu banyak panas, yang mampu melelehkan besi dan banyak digunakan untuk mengelas rel kereta api.
Kondensasi air
Untuk semua zat, perubahan fase gas (kondensasi), cair hingga padat (pemadatan) dan gas padat (deposisi), selalu lepaskan panas dan karenanya merupakan proses eksotermik. Dalam kasus air, kondensasi hanya 18 gram pelepasan air sekitar 10.000 kalori, yang cukup untuk memanaskan 15 cangkir kopi kecil.
Referensi
- Chang, R. dan goldsby, k. (2014). Kimia. Edisi ke -11. New York: Pendidikan McGraw-Hill.
- Reaksi Eksotermik (2020, 19 Desember). Di Wikipedia. Diambil dari.Wikipedia.org
- Holmes, w. S. (1963). Panas pembakaran fosfor dan entalpi pembentukan P4O10 dan H3PO4. Faraday Soc. 58. 1916-1925. Doi: 10.1039/TF9625801916.
- Prada p. dari., F. yo. (2014). Petasan, roket, dan banyak chemistry. Pendidikan Kimia. 44-51. Doi: 10.2436/20.2003.02.134
- Reaksi termit. University of Minnesota (Departemen Kimia). Diambil dari Chem.Umn.Edu

