Aturan oktet

- 2339
- 725
- Miss Marion Graham
 Representasi molekul karbon dioksida yang menunjukkan kepatuhan dengan aturan oktet
Representasi molekul karbon dioksida yang menunjukkan kepatuhan dengan aturan oktet Apa aturan oktet?
Itu Aturan oktet Ini adalah aturan praktis yang menjelaskan pembentukan ikatan kimia dari elemen -elemen representatif berdasarkan konfigurasi elektronik lapisan valensi -nya.
Menurut aturan ini, atom -atom bergabung satu sama lain sedemikian rupa sehingga setiap atom dikelilingi oleh delapan elektron di lapisan valensi (karenanya kata oktet).
Aturan ini diterbitkan secara bersamaan dalam 1.916 Gilbert Lewis dan Walther Kossel. Ini mencerminkan pengamatan bahwa gas mulia sangat stabil dan semua, dengan pengecualian helium, mereka ditandai dengan memiliki lapisan valensi dengan 8 elektron.
Teori ini menetapkan bahwa atom berbagi atau menukar elektron dengan membentuk ikatan kimia, untuk memperoleh konfigurasi elektronik pelapis penuh ini.
Aturan oktet dan struktur lewis
Aturan oktet dan struktur Lewis terkait erat. Ini karena aturan oktet adalah salah satu basis untuk memahami pembentukan ikatan kimia, sehingga memungkinkan untuk memprediksi dalam banyak kasus, struktur lewis bahan kimia.
Dalam pengertian ini, salah satu langkah penting untuk menggambar struktur Lewis, setelah menempatkan hubungan sederhana antara semua atom yang membentuk molekul, adalah untuk mendistribusikan elektron valensi yang tersisa di antara atom -atom paling elektronegatif untuk menyelesaikan oktet mereka.
Dalam kasus di mana oktet tanpa mengisi, ikatan ganda atau tiga terbentuk, selalu mencari aturan oktet untuk sebanyak mungkin atom. Jadi aturan empiris ini sangat penting untuk pembangunan struktur Lewis.
Itu dapat melayani Anda: perak yoduro (AGI): struktur, sifat, mendapatkan, menggunakanContoh Kepatuhan dengan Aturan Octet
Aturan oktet terutama diterapkan pada elemen yang representatif, yaitu, pada blok S dan P dari tabel periodik. Aturan ini secara konsisten diterapkan pada senyawa yang mengandung karbon, nitrogen, oksigen dan halogen, dan dengan beberapa pengecualian untuk elemen lain dari blok P. Namun, sebagian besar logam transisi tidak mematuhi.
Beberapa contoh senyawa di mana aturan oktet dipenuhi untuk semua atom adalah:
Karbon dioksida (CO2)
Seperti dapat dilihat dalam struktur Lewis karbon dioksida yang disajikan di bawah ini, baik karbon pusat dan kedua atom oksigen sesuai dengan aturan oktet.
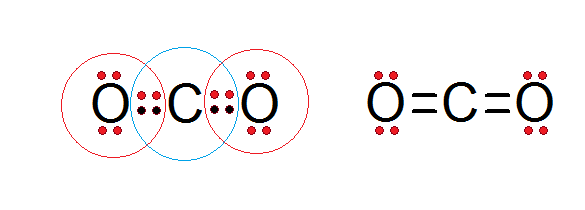
Karbon dikelilingi oleh 4 elektron valensi, ditambah dua elektron dari masing -masing oksigen, yang berkontribusi membentuk ikatan rangkap C = O, sedangkan setiap oksigen dikelilingi oleh 6 elektron sendiri ditambah sepasang dari karbon.
Neopentano (c5H12)
Dalam sebagian besar senyawa organik, semua atom memenuhi aturan oktet (kecuali untuk hidrogen yang dikelilingi oleh hanya 2 elektron). Ini termasuk alkana seperti neopentano atau 2,2-dimethylpropane:
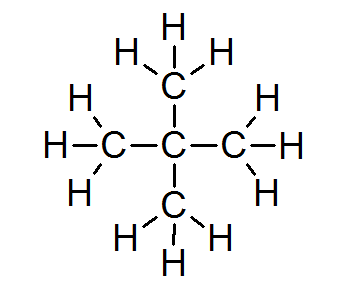
Dalam hal ini juga dapat dilihat bahwa setiap atom karbon berbagi empat elektronnya dengan 4 atom tetangga, yang masing -masing menyediakan salah satu elektronnya untuk membentuk 4 ikatan kovalen sederhana yang tetap bersama.
Untuk alasan ini, setiap atom karbon dikelilingi oleh 8 elektron valensi, sesuai dengan aturan oktet.
Dapat melayani Anda: energi aktivasiKarbon monoksida (CO)
Karbon monoksida adalah senyawa molekul lain di mana oksigen dan karbon berbagi elektron yang membentuk ikatan kovalen untuk memenuhi aturan oktet.
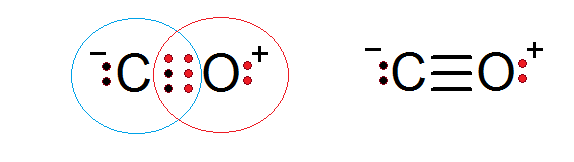
Dalam hal ini, karbon menyediakan dua elektron dan oksigen 4 untuk menyelesaikan 6 elektron yang diperlukan untuk membentuk ikatan kovalen tiga yang menyatukannya. Masing -masing dari dua atom memiliki elektron tambahan tanpa berbagi yang melengkapi setiap oktet.
Anion nitrat (tidak3-)
Juga dalam kasus ion aturan oktet terpenuhi. Ion nitrat memiliki atom nitrogen sentral yang dikelilingi oleh 3 atom oksigen.
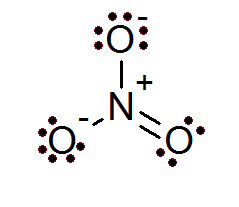
Seperti dapat dilihat dalam kasus ini, semua atom memiliki oktet penuh, dua oksigen memiliki beban formal negatif sementara nitrogen memiliki beban formal positif, yang menghasilkan beban bersih ion -1 nitrat ion nitrat.
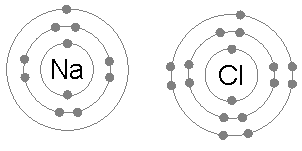
Sodium Chloride (NaCl)
Pertukaran elektron untuk membentuk senyawa ionik juga merupakan contoh umum dari penerapan aturan oktet.
Saat natrium klorida terbentuk dari klorin dan natrium, dimulai dari dua atom yang tidak mematuhi aturan oktet, karena natrium pada elektron dan klorin tidak memiliki satu untuk menyelesaikan oktetnya.
Kemudian, natrium memberikan elektron ke klorin, meninggalkan kation dikelilingi oleh 8 elektron dan pada gilirannya menyelesaikan oktet ke klorin dengan membentuk ion klorida.
 Pengecualian untuk aturan oktet
Pengecualian untuk aturan oktet
Sama seperti ada sejumlah besar senyawa di mana semua atom memenuhi aturan oktet, ada juga beberapa contoh atom yang tidak mematuhi itu.
Itu dapat melayani Anda: Potensi z: Nilai, derajat koagulasi, penentuan, penggunaanBeberapa dikelilingi oleh kurang dari 8 elektron, jadi mereka spesies elektron yang buruk, sementara yang lain dikelilingi oleh lebih dari delapan elektron, dalam hal ini dikatakan bahwa ia memiliki oktet yang diperluas atau dipanggil Atom hipervalen.
Contoh spesies elektron yang buruk
Bordean (bh3)
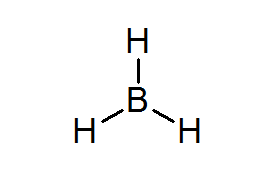
Senyawa ini adalah contoh khas dari jenis elektron yang buruk. Baik boron maupun hidrogen di sekitarnya, tidak memiliki cukup elektron untuk memenuhi aturan oktet dalam atom pusat. Ini menyebabkan Boron menerima beberapa elektron dari atom lain dalam molekul lain, mengubah bordeal menjadi asam dari Lewis.
Aluminium Triclurur (ALCL3)
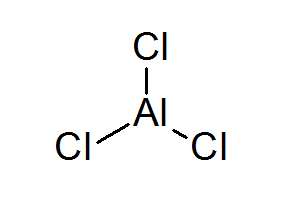
Alcl3 Ini adalah contoh lain dari asam Lewis yang berutang perilaku kimianya yang tidak memenuhi aturan oktet.
Contoh spesies hipervaluen
Belerang heksafluoruro (sf6)
Contoh khas dari oktet yang diperluas adalah SF6, yang biasanya direpresentasikan sebagai belerang tengah dengan 6 ikatan kovalen sederhana dengan atom fluorin. Dalam hal ini, belerang dikelilingi oleh 12 elektron valensi, bukan 8, sehingga melanggar aturan oktet.
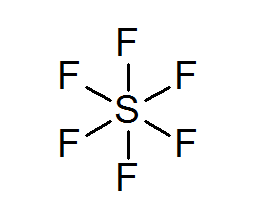
Meskipun demikian, model telah diusulkan di mana belerang sebenarnya terkait dengan ikatan kovalen dengan 4 fluor pada saat yang sama, sedangkan dengan dua lainnya, membentuk ikatan ionik. Jika demikian, itu akan memenuhi aturan oktet.
Fosfor pentachloride (PCL5)
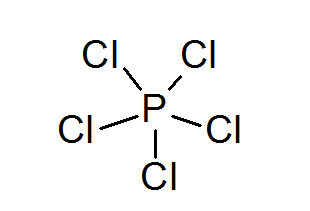
Seperti dalam kasus belerang, fosfor juga dapat membentuk senyawa dengan oktet yang diperluas, dalam hal ini dikelilingi oleh 10 elektron.

