Formula Garam Dasar, Properti, Nomenklatur, Contoh

- 4745
- 123
- Pete Lesch
Itu garam dasar Mereka adalah semua yang larut dalam air menghasilkan solusi dengan nilai pH lebih besar dari 7. Ini dijelaskan oleh Formasi Ion Oh-, yang datang langsung dari proses pembubaran atau keseimbangan hidrolisis di mana anion berpartisipasi.
Garam dasar mengandung anion oh- Dalam padatan mereka. Misalnya, alkali hidroksida, seperti natrium dan kalium, NaOH dan KOH, dianggap sebagai anggota garam -garam ini; Meskipun mereka sangat pedas, itulah sebabnya mereka layak mendapatkan denominasi hidroksida alih -alih disebut garam.
 Natrium hidroksida adalah contoh garam dasar
Natrium hidroksida adalah contoh garam dasar Garam dasar lainnya malah memiliki anion seperti karbonat, CO32-. Karbonat berasal dari asam karbonat, h2BERSAMA3, Asam lemah. Oleh karena itu, garam karbonat, seperti kalsium karbonat yang digunakan dalam antasida, diklasifikasikan sebagai garam dasar. Alasan yang sama berlaku untuk natrium bikarbonat, nahco3, Dan untuk semua garam bikarbonat lainnya.
Garam dasar penting karena beberapa di antaranya membantu menetralkan keasaman makanan. Mereka juga dapat digunakan untuk menyiapkan solusi redaman untuk pH alkali.
[TOC]
Definisi
Garam Dasar memiliki dua definisi yang saling melengkapi: mereka mengandung anion OH- Dalam padatan mereka, atau menghasilkan anion hidroksi yang sama setelah kristal mereka larut dalam air.
Terlepas dari definisi yang dipilih, pH solusi airnya akan lebih besar dari 7, dan oleh karena itu, mereka akan menjadi basa atau dasar.
Formula Umum Garam Dasar
Klarifikasi apa yang dipahami oleh garam dasar, formulanya, meskipun tidak sepenuhnya umum, adalah sebagai berikut:
MN(OH)WXov
Di mana m adalah kation logam atau amonium, oh hidroksil, dan xo anion yang berasal dari asam yang lemah atau kuat. Subskrip N, W Dan v Berapa banyak m, oh dan xo, masing -masing, membentuk garam dasar, serta proporsi mereka.
Perhatikan itu v Ini bisa sama dengan nol, yang berarti bahwa kita memiliki alkali atau alkalinoterreo hidroksida. Inilah yang terjadi dengan Naoh dan Koh. Juga, W Itu bisa nol, yang berarti tidak ada ion oh-. Misalnya, Caco3 Itu tidak ada oh-, Namun itu tetap menjadi garam dasar.
Dapat melayani Anda: kalsium sulfida (CAS): struktur, sifat, mendapatkan, penggunaanDari atas disimpulkan bahwa formula umum garam dasar adalah mN(OH)WXov, Tapi tidak semua garam mematuhi ini. Oleh karena itu, faktor yang lebih penting untuk dipertimbangkan adalah sifat xo anion. Dengan demikian, akan diketahui ketika garam adalah dasar, terlepas dari apakah ada ion oh atau tidak- Dalam formula mereka.
Sifat Garam Dasar
Garam dasar larut dalam air mengikuti persamaan berikut:
MN(OH)WXov(S) → NM+(AC) + WOh-(AC) + vXo-(AC)
Perhatikan bahwa saat larut melepaskan ion OH- di dalam air. Ini mempengaruhi pH larutan, menjadi basa dengan nilai lebih besar dari 7. Misalnya, kalsium nitrat dasar larut dalam air sesuai dengan bagaimana hal itu berikut:
CA (OH) Tidak3(S) → CA2+(Ac) + oh-(AC) + Tidak3-(AC)
Nilai -nilai N, W Dan v Mereka sama dengan 1 untuk garam ini.
Di sisi lain, garam dasar yang tidak memiliki oh-, Tetapi anion yang berasal dari asam lemah dihidrolisis di dalam air:
Maling3(S) → CA2+(ac) + co32-(AC)
BERSAMA32-(Ac) + h2Atau (l) ⇌ hco3-(Ac) + oh-(AC)
Perhatikan bahwa produk hidrolisis ini adalah anion oh-. Dari sana terletak alkalinitas dari pangkalan -pangkalan ini. Namun, dan seperti yang diharapkan, mereka kurang mendasar dibandingkan dengan yang sudah memiliki ion oh- hadir dalam kristal mereka. Misalnya, NaOH sangat mendasar:
NaOH (S) → NA+(Ac) + oh-(AC)
Nah, lepaskan ion Oh- langsung segera setelah air menyentuh; Atau lebih buruk lagi, nyaris tidak menyentuh kelembaban kulit.
Dapat melayani Anda: karbokation: pembentukan, karakteristik, jenis, stabilitasSifat fisik atau kimia lainnya dari garam dasar tidak terlalu berbeda dari yang dari garam netral atau asam lainnya.
Tata nama
Nomenklatur garam dasar tergantung pada sifat anion xo: jika monoatomik, atau jika itu adalah okoanion. Namun, bagian ini akan fokus terutama pada garam dasar dengan anion oh-. Mereka yang tidak memilikinya, memiliki nomenklatif yang lebih mudah untuk dihafal atau bernalar.
Dengan anion monoatomik
Anion monoatomik tidak direpresentasikan sebagai xo, tetapi sebagai x. Mereka berasal dari HX hydraceide, seperti asam fluorida, HF, atau asam klorida, HCl, dan sebagainya.
Dalam kasus ini, mereka dinamai secara sistematis dalam dua cara:
(Awalan angka kecuali monyet) hydroxi + nama anion diakhiri dengan akhiran -uro + nama logam dengan valensi dalam tanda kurung (jika memiliki lebih dari satu)
Misalnya, Salt Ni (OH) CL disebut nikel hidroksychloride (II).
Nama anion dengan terminasi -uro + -(awalan angka kecuali monyet) hidroksida + nama logam dan valensinya dalam tanda kurung
Misalnya, Salt Ni (OH) CL juga dapat dinamai sebagai nikel klorida-hidroksida (II).
Kami juga memiliki nomenklatur tradisional, terkadang dicampur dengan sistematis:
Nama anion diikuti oleh (awalan angka kecuali monyet) dasar dan nama logam dengan sufiks -ooso atau -ico seperti yang diterapkan.
Misalnya, Ni (OH) Cl disebut nikel klorida dasar, atau nikel klorida dasar (II).
Dengan oxoanion
Nomenklatur sistematis untuk garam dasar yang memiliki oxoanion sedikit lebih rumit. Namun, versi paling sederhana dibangun sebagai berikut:
(Awalan angka) hidroksida- (nama anion) + dari + nama logam dan valencia dalam tanda kurungnya
Misalnya, iman (oh) tidak3 disebut: hidroksida-besi nitrat (II).
Ini juga memiliki nomenklatur tradisional:
Nion Basic + (Awalan Numeral) Nama + Nama Logam Berakhir di -OSO atau -ICO
Dapat melayani Anda: oksigen: sifat, struktur, risiko, penggunaanJadi, iman (oh) tidak3 Ini disebut: ferrous dasar nitrat, atau nitrat besi dasar (II).
Pelatihan
Garam dasar adalah produk dari netralisasi asam-basa, khususnya antara hidrasi atau oxoacid dengan kelebihan basa atau hidroksida:
Basa (berlebih) + asam → garam basa atau alkali + air
Misalnya, CA (OH) Tidak3 Ini dibentuk dengan menetralkan asam nitrat dengan kelebihan kalsium hidroksida:
CA (OH)2(Berlebih) + hno3 → CA (OH) Tidak3 + H2SALAH SATU
Pembentukan pelatihan lainnya adalah sebagai berikut:
Iman (oh)3(Kelebihan) + h2Sw4 → fe (oh) jadi4 + 2h2SALAH SATU
Garam ini disebut: ferric sulfat dasar, besi sulfat dasar (III), atau besi hidroksida-sulfat (III).
Contoh garam dasar
 Antasida, seperti kalsium karbonat, CaCO3, adalah contoh garam dasar. Sumber: Pixabay.
Antasida, seperti kalsium karbonat, CaCO3, adalah contoh garam dasar. Sumber: Pixabay. Akhirnya, beberapa contoh garam dasar lainnya akan terdaftar bersama dengan nama yang lebih sederhana:
-Nach3COO: Sodium asetat
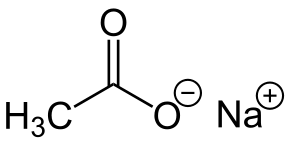 Sodium asetat
Sodium asetat -Na2S: Sodium sulfida
 Sodium sulfida
Sodium sulfida -KCN: Kalium sianida
-Mgco3: magnesium karbonat
-Iman (oh) begitu3: Sulphite besi dasar (III)
-Iman (oh) (c6H5Mendekut)2: Basic Iron Benzoate (III)
-AUCL (OH)2: Emas Dibasic Chloride (III)
-Cuclo3(OH): Dasar Tembaga Klorat (II)
-Di (oh) jadi4: Aluminium sulfat dasar
-PB (OH)2BERSAMA3: Karbonat timbal dibasic (iv)
Masalah garam dasar adalah bahwa tidak semuanya dapat disiapkan, karena kelebihan basa atau hidroksida tidak cukup untuk mengkristal mereka tanpa menggunakan proses lain. Itu adalah kasus PB (OH)2BERSAMA3. Namun, karbonat ini memang ada sebagai pigmen timbal putih (ii), yang formulanya 2PBCO3· PB (OH)2 atau pb3(OH)2(BERSAMA3)2.
Referensi
- Whitten, Davis, Peck & Stanley. (2008). Kimia. (Edisi ke -8.). Pembelajaran Cengage.
- Shiver & Atkins. (2008). Kimia anorganik. (Edisi keempat). MC Graw Hill.
- Wikipedia. (2020). Garam alkali. Diperoleh dari: di.Wikipedia.org
- Wu c., Dowell c. & Hooper n. (1 Juli 2014). Sifat asam-basa garam. Pulih dari: chem.Librettexts.org
- Nicola McDougal. (2020). Larutan Garam Asam & Dasar: Penjelasan & Contoh. Belajar. Pulih dari: belajar.com
- Latihan Masalah dan Kimia. (S.F.). Garam dasar. Pulih dari: acorral.adalah
- « Konsep dan contoh struktur material
- Karakteristik fungsi yang terhuyung -huyung, contoh, latihan »

