Garam organik
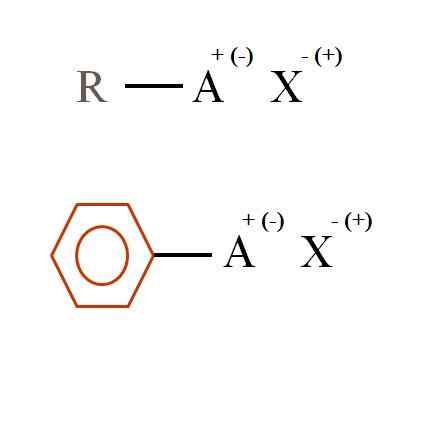
- 968
- 206
- Irvin Reichel
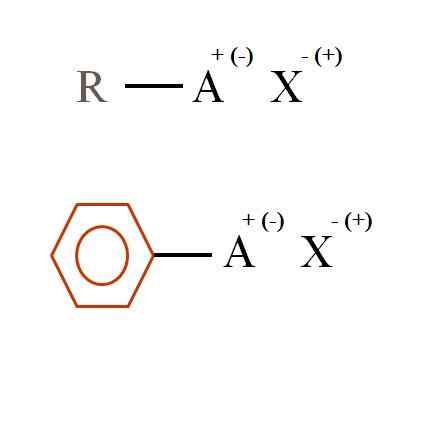 Dua formula kimia umum untuk garam organik. Sumber: Gabriel Bolívar
Dua formula kimia umum untuk garam organik. Sumber: Gabriel Bolívar Apa itu garam organik?
Itu Garam organik Mereka adalah jumlah senyawa ionik yang padat dengan fitur yang tak terhitung banyaknya. Sebelumnya berasal dari senyawa organik, yang telah mengalami transformasi yang memungkinkannya menjadi kargo, dan bahwa identitas kimianya tergantung pada ion yang terkait.
Dalam gambar superior dua formula kimia yang sangat umum ditampilkan untuk garam organik. Yang pertama, R-AX, ditafsirkan sebagai senyawa di mana struktur karbon atom, atau grup A, memakai beban + positif atau negatif (-).
Seperti yang dapat dilihat, ada ikatan kovalen antara R dan A, R-A, tetapi pada gilirannya, ia memiliki beban formal yang menarik (atau mengusir) ke ion x. Tanda beban akan tergantung pada sifat A dan lingkungan kimia.
Jika positif, berapa banyak x yang bisa berinteraksi? Dengan satu, diberi prinsip elektroneutralitas (+1-1 = 0). Namun, apa identitas x? Anion x bisa menjadi co32-, membutuhkan dua kation ra+; A halogenide: f-, Cl-, Br-, dll.; atau bahkan senyawa lain-. Opsi tidak terhitung.
Demikian juga, garam organik bisa aromatik, diilustrasikan dalam cincin coklat benzenik. Tembaga benzoat garam (II), (c6H5Mendekut)2Cu, misalnya, terdiri dari dua cincin aromatik dengan kelompok karboksi yang dimuat secara negatif, yang berinteraksi dengan kation Cu2+.
Sifat fisik dan kimia garam organik
Dari gambar dapat ditegaskan bahwa garam organik terdiri dari tiga komponen: organik, R atau AR (cincin aromatik), atom atau pembawa kelompok beban ionik A, dan counterion x.
Sama seperti identitas dan struktur kimia didefinisikan oleh komponen seperti itu, dengan cara yang sama sifatnya bergantung padanya.
Dari fakta ini, sifat umum tertentu yang memenuhi sebagian besar garam ini dapat diringkas.
Dapat melayani Anda: nomor oksidasi: konsep, cara mengeluarkannya dan contohMassa molekul tinggi
Dengan asumsi anion anorganik mono atau serbaguna, garam organik biasanya memiliki massa molekul yang jauh lebih besar daripada garam anorganik. Ini terutama karena kerangka berkarbonasi, yang ikatan C-C yang sederhana, dan atom hidrogennya, memberikan banyak massa untuk senyawa.
Oleh karena itu, mereka adalah mereka yang bertanggung jawab atas massa molekul tinggi mereka.
Amfiphylic dan surfaktan
Garam organik adalah senyawa amphiphilic, yaitu, strukturnya memiliki hidrofilik dan hidrofobik ekstrem.
Apa yang ekstrem seperti itu? R atau AR mewakili ujung hidrofobik, karena atom C dan H mereka tidak memiliki afinitas besar terhadap molekul air.
KE+(-), Grup atom atau pembawa kargo adalah ujung hidrofilik, karena berkontribusi pada momen dipol dan berinteraksi dengan dipol yang membentuk air (RA+ Oh2).
Saat daerah hidrofilik dan hidrofobik terpolarisasi, garam amfifilik menjadi surfaktan, suatu zat yang banyak digunakan untuk elaborasi deterjen dan unullamping.
Titik didih atau fusi yang tinggi
Seperti garam anorganik, garam organik juga memiliki titik peleburan dan mendidih yang tinggi, karena kekuatan elektrostatik yang mengatur dalam fase cair atau padat.
Namun, memiliki komponen organik R atau AR, jenis lain dari van der Waals (London, dipolo-dipolo, jembatan hidrogen) berpartisipasi dalam beberapa cara dengan elektrostatik.
Untuk alasan ini, struktur padat atau cair garam organik, pada contoh pertama, lebih kompleks dan bervariasi. Beberapa dari mereka bahkan bisa berperilaku seperti kristal cair.
Keasaman dan Basa
Garam organik biasanya asam atau basa lebih kuat dari garam anorganik. Ini karena, misalnya, dalam garam amina, ia memiliki beban positif karena hubungannya dengan hidrogen tambahan: a+-H. Kemudian, dalam kontak dengan pangkalan, donasi proton menjadi senyawa netral lagi:
Itu dapat melayani Anda: strontium: riwayat, struktur, sifat, reaksi dan penggunaanRa+H + b => ra + hb
H milik A, tetapi ditulis, karena mengintervensi dalam reaksi netralisasi.
Di sisi lain, RA+ Ini bisa berupa molekul besar, tidak dapat membentuk padatan dengan jaringan kristal yang stabil dengan anion hidroksil atau oxhydrilo oh-.
Saat demikian, Ram garam+Oh- Itu berperilaku seperti basis yang kuat; Bahkan sama dasarnya dengan NaOH atau KOH:
Ra+Oh- + Hcl => racl + h2SALAH SATU
Perhatikan dalam persamaan kimia bahwa Anion CL- ganti oh-, membentuk garam ra+Cl-.
Penggunaan garam organik
Penggunaan garam organik akan bervariasi sesuai dengan identitas r, ar, a dan x. Selain itu, aplikasi yang dialokasikan juga tergantung pada jenis padatan atau cairan yang mereka terbentuk. Beberapa generalisasi dalam hal ini adalah:
- Mereka berfungsi sebagai reagen untuk sintesis senyawa organik lainnya. Rax dapat bertindak sebagai "pemberi" dari rantai R untuk menambah senyawa lain yang menggantikan kelompok keluar yang baik.
- Mereka adalah surfaktan, sehingga mereka juga dapat digunakan sebagai pelumas. Garam logam karboksilalat digunakan untuk tujuan ini.
- Mereka memungkinkan untuk mensintesis berbagai pewarna.
Contoh garam organik
Karboksilat
Asam karboksilat bereaksi dengan hidroksida dalam reaksi netralisasi, menyebabkan garam karboksilalat: rcoo- M+; dimana m+ Ini bisa berupa kation logam (NA+, Pb2+, K+, dll.) atau kation amonium nh4+.
Asam lemak adalah asam karboksilat rantai panjang, mereka dapat jenuh dan tidak jenuh. Asam palmitat adalah di antara yang jenuh (pilih3(Ch2)14Cooh). Ini berasal dari garam palmitat, sedangkan asam stearat (cho3(Ch2)16COOH membentuk garam stear. Sabun dibentuk dari garam ini.
Dapat melayani Anda: hukum gas umumDalam kasus asam benzoat, c6H5CoOH (di mana c6H5- Itu adalah cincin benzena), saat bereaksi dengan dasar membentuk garam benzoat. Di semua karboksilasi grup -co- Mewakili (rax).
Lithium Diaquilcupratos
Lithium Day berguna dalam sintesis organik. Formulasinya adalah [R-CU-R]-Li+, di mana atom tembaga membawa beban negatif. Di sini, tembaga mewakili atom gambar.
Garam sulfonium
Mereka terbentuk dari reaksi sulfida organik dengan alkil halogenida:
R2S + r'x => r2R+X
Untuk garam ini, atom belerang membawa beban formal positif+) Memiliki tiga tautan kovalen.
Garam Oxyio
Demikian juga, eter (analog teroksigenasi dari sulfida) bereaksi dengan hidraceid untuk membentuk kamar oksi:
Ror ' + hbr ro+HR ' + BR-
Proton asam HBR secara konsisten terkait dengan atom oksigen eter (R2SALAH SATU+-H), menagihnya secara positif.
Garam Amina
Amina bisa menjadi primer, sekunder, tersier atau kuaterner, seperti garamnya. Semuanya ditandai dengan memiliki atom H yang terkait dengan atom nitrogen.
Jadi, rnh3+X- Ini adalah garam amina primer; R2NH2+X-, Amina sekunder; R3NH+X-, dari amina tersier; dan r4N+X-, amina kuaterner (garam amonium kuaterner).
Garam Diazonium
Akhirnya, garam diazonium (RN2+X-atau Arildiazonium (RNA2+X-), mereka mewakili titik awal dari banyak senyawa organik, terutama pewarna azoik.
Referensi
- Francis a. Tortoiseshell. Kimia Organik (Edisi Keenam, PP. 604-605, 697-698, 924). MC Graw Hill.
- Graham Solomons t.W., Craig b. Fryhle. Kimia organik. Amina (edisi ke -10.). Wiley Plus.
- Wikipedia (2018). Garam (kimia). Diambil dari: di.Wikipedia.org
- Steven a. Hardinger (2017). Glosari Ilustrasi Kimia Organik: Garam. Pulih dari: chem.UCLA.Edu
- Chevron Oronite (2011). Karboksilat. [PDF]. Pulih dari: oronite.com

