Sejarah Selenium, Sifat, Struktur, Perolehan, Penggunaan

- 4982
- 144
- Miss Marion Graham
Dia selenium Ini adalah bahan kimia non -logam yang termasuk dalam kelompok 16 dari tabel periodik dan diwakili oleh simbol adalah. Elemen ini memiliki sifat menengah antara sulfur dan telurio, yang merupakan anggota dari kelompok yang sama.
Selenium ditemukan pada tahun 1817 oleh Jöhs J. Berzelius dan John G. Gahn, yang menguapkan pirit mengamati residu merah (gambar bawah). Awalnya mereka membingungkannya dengan telurio, tetapi kemudian menyadari bahwa mereka menghadapi elemen baru.
 Botol dengan selenium merah amorf, alotropik yang paling terkenal untuk elemen ini. Sumber: w. Oelen [CC BY-SA 3.0 (https: // createveCommons.Org/lisensi/by-sa/3.0)]
Botol dengan selenium merah amorf, alotropik yang paling terkenal untuk elemen ini. Sumber: w. Oelen [CC BY-SA 3.0 (https: // createveCommons.Org/lisensi/by-sa/3.0)] Berzelius menyebut elemen baru sebagai selenium, berdasarkan nama "selene" yang berarti "dewi bulan". Selenium adalah jejak penting untuk tanaman dan hewan, meskipun dalam konsentrasi tinggi itu adalah elemen beracun.
Selenium memiliki tiga bentuk alotropik utama: merah, hitam dan abu -abu. Yang terakhir memiliki sifat memodifikasi konduktansi listriknya berdasarkan intensitas cahaya yang memancarkannya (fotokonduktor), sehingga memiliki banyak aplikasi.
Selenium didistribusikan secara luas di kerak bumi, namun mineral yang mengandungnya tidak berlimpah, jadi tidak ada eksploitasi penambangan selenium.
Ini terutama diperoleh sebagai produk sekunder dari proses pemurnian dengan elektrolisis tembaga. Selenium menumpuk di lendir yang berada di anoda sel elektrolisis.
Manusia memiliki sekitar 25 seleenoprotein, beberapa di antaranya memenuhi tindakan antioksidan dan mengendalikan generasi radikal bebas. Ada juga asam amino selenium, seperti selenomectionine dan selenocysteine.
[TOC]
Sejarah
Pengamatan pertama
Alkemis Arnold dari Villanova mungkin telah mengamati selenium pada tahun 1230. Ini terbentuk dalam kedokteran di Sorbonne of Paris, dan bahkan dokter Paus Clemente v.
Villanova dalam bukunya Rosarium filsafat Jelaskan sulfur merah atau "sulfur reboule" yang tetap dalam oven setelah menguapkan sulfur. Sulfur merah ini bisa menjadi alotropik selenium.
Penemuan
Pada tahun 1817, Jöhs Jakob Berzelius dan John Gottlieb Gahn menemukan selenium di pabrik kimia untuk produksi asam sulfat, dekat Gripsholm, Swedia. Bahan baku untuk elaborasi asam adalah pirit, yang diekstraksi dari tambang falun.
Berzelius dipukul oleh keberadaan residu merah yang tetap di dalam wadah timah setelah belerang terbakar.
Juga, Berzelius dan Gahn mengamati bahwa residu merah memiliki aroma lobak pedas yang kuat, mirip dengan yang disajikan oleh telurio. Alasan mengapa, dia menulis kepada temannya Marect bahwa mereka percaya bahwa deposit yang diamati adalah senyawa telurio.
Namun, Blelius terus menganalisis bahan yang disimpan dengan membakar pirit dan mempertimbangkan kembali bahwa telurio belum ditemukan di falun. Menyimpulkan pada bulan Februari 1818 bahwa ia telah menemukan elemen baru.
Asal nama Anda
Berzelius menunjukkan bahwa elemen baru adalah kombinasi sulfur dan telurio, dan bahwa kesamaan telurio dengan elemen baru telah memberinya kesempatan untuk menyebutkan zat selenium yang baru.
Berzelius menjelaskan bahwa "tellus" berarti dewi bumi. Martin Klaport pada 1799 menempatkan nama ini ke telurio dan menulis: “Tidak ada elemen yang hanya disebut seperti itu. Itu harus dilakukan!".
Karena kesamaan telurio dengan zat baru, Berzelius menyebutnya dengan kata selenium, berasal dari kata Yunani "selene" yang berarti "dewi bulan".
Pengembangan aplikasi Anda
Pada tahun 1873 Willoughby Smith menemukan bahwa konduktivitas listrik yang disajikan oleh selenium tergantung pada cahaya yang memancarkannya. Properti ini memungkinkan Selenium memiliki banyak aplikasi.
Alexander Graham Bell pada tahun 1979 menggunakan selenium dalam fotofonnya. Selenium menghasilkan arus listrik yang sebanding dengan intensitas cahaya yang menerangi, menggunakan meter cahaya, mekanisme keamanan untuk pembukaan dan penutupan pintu, dll.
Penggunaan penyearah selenium dalam elektronik dimulai dari tahun 1930 -an, dengan banyak aplikasi komersial. Pada tahun 1970 -an ia digantikan di penyearah untuk silikon.
Pada tahun 1957 ditemukan bahwa selenium adalah elemen penting untuk kehidupan mamalia, karena ada dalam enzim yang melindungi dari oksigen reaktif dan radikal bebas. Selain itu, keberadaan asam amino seperti selenometionine ditemukan.
Sifat fisik dan kimia
Penampilan
Ada beberapa alotrop untuk selenium, penampilan fisiknya bervariasi. Biasanya disajikan sebagai padatan kemerahan dalam bentuk debu.
Berat atom standar
78.971 u
Nomor Atom (Z)
3. 4
Titik lebur
221 ºC
Titik didih
685 ºC
Kepadatan
Kepadatan selenium bervariasi tergantung pada alotropik atau polimorf yang dipertimbangkan. Beberapa kepadatan yang ditentukan pada suhu kamar adalah:
Abu -abu: 4,819 g/cm3
Alfa: 4.39 g/cm3
Vitreous: 4.28 g/cm3
Keadaan cair (titik lebur): 3,99 g/cm3
Panas fusi
Abu -abu: 6.69 kJ/mol
Panas penguapan
95,48 kJ/mol
Kapasitas kalori molar
25.363 J/(mol · k)
Angka oksidasi
Selenium dapat dihubungkan dalam senyawanya yang memanifestasikan angka -angka atau status oksidasi berikut: -2, -1, +1, +2, +3, +4, +5, +6. Di antara mereka, yang paling penting adalah -2 (2-), +4 (saya tahu4+) dan +6 (saya tahu6+).
Dapat melayani Anda: mikroskop sederhanaMisalnya, di SEO2 Selenium memiliki nomor oksidasi +4; yaitu, keberadaan kation diasumsikan4+ (DIA4+SALAH SATU22-). Mirip dengan SEO3 Selenium memiliki nomor oksidasi +6 (i6+SALAH SATU32-).
Dalam hidrogen seleniuro, h2SE, selenium memiliki jumlah oksidasi -2; yaitu, sekali lagi, keberadaan ion atau anion diasumsikan2- (H2+DIA2-). Ini karena selenium lebih elektronegatif daripada hidrogen.
Elektronegativitas
2.55 pada skala Pauling.
Energi ionisasi
-Pertama: 941 kJ/mol.
-Kedua: 2.045 kJ/mol.
-Ketiga: 2.973,7 kJ/mol.
Urutan magnetik
Diamagnetik.
Kekerasan
2.0 pada skala Mohs.
Isotop
Ada lima isotop selenium alami dan stabil, yang ditunjukkan di bawah ini dengan kelimpahan masing -masing:
-74SE (0,86%)
-76SE (9,23%)
-77SE (7,6%)
-78SE (23,69%)
-80SE (49,8%)
Alotropi
 Botol hitam dilapisi dengan film tipis Grey Selenium. Sumber: w. Oelen [CC BY-SA 3.0 (https: // createveCommons.Org/lisensi/by-sa/3.0)]
Botol hitam dilapisi dengan film tipis Grey Selenium. Sumber: w. Oelen [CC BY-SA 3.0 (https: // createveCommons.Org/lisensi/by-sa/3.0)] Selenium yang disiapkan dalam reaksi kimia adalah bubuk amorf merah bata, yang ketika bentuk hitam vitreous didirikan, mirip dengan akun Rosario (gambar superior). Selenium hitam adalah padatan yang rapuh dan berkilau.
Selain itu, selenium hitam sedikit larut dalam karbon sulfida. Saat larutan ini dipanaskan pada 180 ºC, selenium abu -abu endapan, alotropiknya yang paling stabil dan padat.
Selenium abu -abu tahan terhadap oksidasi dan inert terhadap aksi asam non -oksidasi. Properti utama selenium ini adalah fotokonduktivitasnya. Diterangi meningkatkan konduktivitas listriknya dengan faktor 10 hingga 15 kali.
Reaktivitas
Selenium dalam senyawanya ada di status oksidasi -2, +4 dan +6. Memanifestasikan kecenderungan yang jelas untuk membentuk asam dalam keadaan oksidasi yang lebih tinggi. Senyawa yang memiliki selenium dengan keadaan oksidasi -2, disebut seleniuros (2-).
Reaksi hidrogen
Selenium bereaksi dengan hidrogen untuk membentuk hidrogen seleniuro (h2SE), gas yang tidak berwarna, mudah terbakar dan bau.
Reaksi oksigen
Selenium terbakar dengan mengeluarkan api biru dan membentuk selenium dioksida:
DIA8 (s) + 8 o2 => 8 SEO2 (S)
Selenium oksida adalah polimer, zat putih dan padat. Hidrasinya menghasilkan asam selenous (h2Seo3). Selenium juga membentuk selenium trioksida (SEO3), Analog dengan belerang (jadi3).
Reaksi dengan halogen
Selenium bereaksi dengan fluoride untuk membentuk selenium hexafluoruro:
DIA8 (s) +24 f2 (g) => 8 sef6 (L)
Selenium bereaksi dengan klorin dan bromin untuk membentuk diklorida dan disilenium dibromure, masing -masing:
DIA8 (s) +4 cl2 => 4 SE2Cl2
DIA8 (s) +4 br2 => 4 SE2Br2
Selenium juga dapat membentuk sef4 dan secl4.
Di sisi lain, selenium membentuk senyawa di mana atom selenium bergabung dengan salah satu halogen dan oksigen lainnya. Contoh penting adalah selenium oxychloride (SEO2Cl2), Dengan selenium dalam oksidasi +6, pelarut yang sangat kuat.
Reaksi dengan logam
Selenium bereaksi dengan logam untuk membentuk aluminium, kadmium dan natrium seleniuros. Bahan kimia di bawah ini sesuai dengan pembentukan aluminium seleniuro:
3 SE8 + 16 al => 8 hingga2DIA3
Selenitas
Selenium membentuk garam yang dikenal sebagai selenitas; Misalnya: selenite perak (AG2Seo3) dan natrium selenite (na2Seo3). Nama ini telah digunakan, dalam konteks sastra, untuk merujuk pada penghuni bulan: selenitas.
Asam
Asam selenium yang paling penting adalah asam sealnat (h2Seo4). Itu sekuat asam sulfat dan lebih mudah dikurangi.
Struktur dan konfigurasi elektronik
- Selenium dan tautannya
Selenium memiliki enam elektron Valencia, itulah sebabnya terletak di kelompok 16, sama seperti oksigen dan belerang. Keenam elektron ini ditemukan di orbital 4S dan 4P, sesuai dengan konfigurasi elektroniknya:
[Ar] 3d10 4s2 4p4
Oleh karena itu, seperti sulfur, membentuk dua ikatan kovalen untuk menyelesaikan oktet Valencia; Meskipun memiliki ketersediaan orbital 4D untuk menghubungkan lebih dari dua atom. Dengan demikian, tiga atom selenium mendekati dan membentuk dua ikatan kovalen: se-se-se.
Selenium dengan massa atom yang lebih besar memiliki kecenderungan alami untuk membentuk struktur yang diatur oleh ikatan kovalen; Alih -alih diatur sebagai molekul diatomik2, Se = se, analog dengan o2, O = O.
- Cincin atau rantai
Di antara struktur molekuler yang diadopsi oleh atom selenium, dua dapat disebutkan secara umum: cincin atau rantai. Perhatikan bahwa dalam kasus hipotetis SE3, Atom masih diperlukan oleh ujungnya; Oleh karena itu, mereka harus terhubung ke atom lain, secara berturut -turut, sampai rantai dapat ditutup dalam sebuah ring.
Cincin yang paling umum adalah dari delapan anggota atau atom selenium:8 (Mahkota selenite). Mengapa delapan? Karena semakin kecil cincinnya, semakin besar ketegangan akan menderita; Yaitu, sudut tautan mereka menyimpang dari nilai -nilai alami yang ditetapkan oleh hibridisasi SP mereka3 (mirip dengan sikloalcanos).
Dapat melayani Anda: jarum suntik pascalAda delapan atom, pemisahan antara atom SE cukup untuk tautan mereka menjadi "santai" dan tidak "dilipat"; Meskipun sudut tautannya adalah 105,7 dan bukan 109,5. Di sisi lain, mungkin ada cincin yang lebih kecil: i6 Dan7.
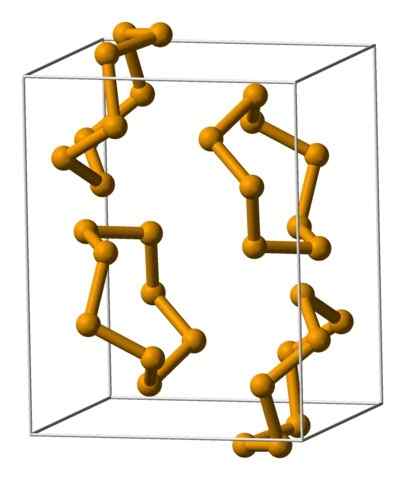 Unit analer selenium diwakili dengan model bola dan batang. Sumber: Benjah-BMM27 [Domain Publik].
Unit analer selenium diwakili dengan model bola dan batang. Sumber: Benjah-BMM27 [Domain Publik]. Pada gambar atas unit analer ditampilkan8. Perhatikan kemiripan yang mereka miliki dengan mahkota belerang; Hanya mereka yang lebih besar dan berat.
Selain cincin, atom selenium juga dapat diatur dalam rantai heliks (pikirkan di tangga siput):
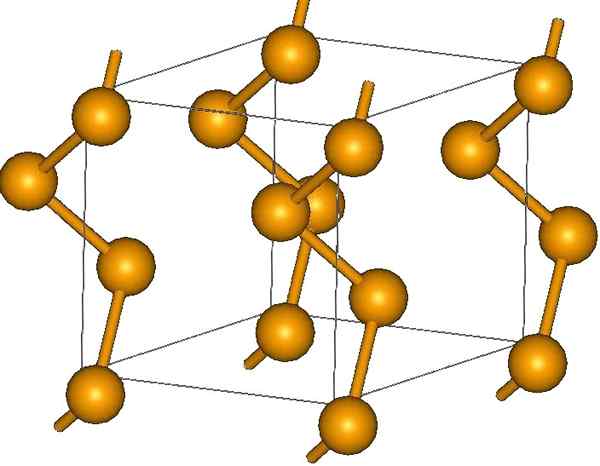 Rantai selenium heliks. Sumber: MaterialScientist at English Wikipedia [CC BY-SA 3.0 (https: // createveCommons.Org/lisensi/by-sa/3.0)]
Rantai selenium heliks. Sumber: MaterialScientist at English Wikipedia [CC BY-SA 3.0 (https: // createveCommons.Org/lisensi/by-sa/3.0)] Di ujungnya mungkin ada tautan terminal ganda (-se = se), atau cincin8.
- Banyak
Dengan mempertimbangkan bahwa mungkin ada cincin atau rantai selenium, dan bahwa dimensinya juga dapat bervariasi tergantung pada jumlah atom yang dikandungnya, maka terbukti bahwa ada lebih dari satu alotropik untuk elemen ini; Ini adalah padatan selenium murni tetapi dengan struktur molekul yang berbeda.
Selenium merah
Di antara alotrop selenium yang paling menonjol yang kita miliki merah, yang dapat disajikan sebagai debu amorf, atau sebagai kristal monoklinik dan polimorfik (lihat gambar cincin adalah8).
Dalam selenium merah amorf, struktur tidak teratur, tanpa pola yang jelas; Saat berada di lensa, cincin membentuk struktur monoklinik. Selenium merah kristal adalah polimorfik, memiliki tiga fase: α, β dan γ, yang berbeda dalam kepadatannya.
Selenium hitam
Struktur selenium hitam juga terdiri dari cincin; Tapi bukan delapan anggota, tetapi banyak lagi, ada hingga cincin seribu atom (1000). Kemudian dikatakan bahwa strukturnya kompleks dan terdiri dari cincin polimer; Beberapa lebih besar atau kecil dari yang lain.
Ketika ada cincin polimer dengan ukuran yang berbeda, sulit untuk menunggu perintah struktural untuk membangun; Jadi selenium hitam juga amorf, tetapi berbeda dengan debu kemerahan yang disebutkan di atas, ia memiliki konteks kaca, meskipun rapuh.
Selenium abu -abu
Dan akhirnya, dari alotrop selenium paling sederhana adalah abu -abu, yang menonjol di atas yang lain dengan menjadi yang paling stabil dalam kondisi normal, dan juga memiliki penampilan logam.
Kristal mereka bisa menjadi heksagonal atau trigonal, didirikan oleh kekuatan dispersi London antara rantai heliks polimerik mereka (citra superior). Sudut tautannya adalah 130,1 º, yang menunjukkan penyimpangan positif dari lingkungan tetrahedral (dengan sudut 109,5 °).
Itulah sebabnya rantai selenium heliks memberi kesan "terbuka". Dengan cara penjelasan, dalam struktur ini atom dihadapkan, jadi secara teori harus ada tumpang tindih yang lebih besar dari orbital mereka untuk membuat pita penggerak.
Panas dengan peningkatan getaran molekuler merusak pita -pita ini ketika rantai tidak teratur; Sementara energi foton secara langsung mempengaruhi elektron, menarik mereka dan mempromosikan transaksi mereka. Dari penglihatan ini, "mudah" untuk membayangkan fotokonduktivitas untuk Selenium Grey.
Dimana dan produksi
Meskipun didistribusikan secara luas, selenium adalah elemen langka. Itu dalam keadaan asli yang terkait dengan sulfur dan mineral seperti eucairita (cuagse), cloustalita (pbse), naumanite (ag ag2SE), dan Crookesite [(cutiag)2DIA].
Selenium ditemukan sebagai pengotor yang menggantikan sulfur dalam sebagian kecil mineral sulfur logam; seperti tembaga, timah, perak, dll.
Ada tanah di mana selenium ada dalam bentuk selenate yang larut. Ini dibawa oleh perairan hujan ke sungai dan dari sana, menuju lautan.
Beberapa tanaman dapat menyerap dan memusatkan selenium. Misalnya, secangkir kacang di Brasil mengandung 544 μg selenium, jumlah yang setara dengan 777% dari jumlah selenium yang direkomendasikan setiap hari.
Pada makhluk hidup, selenium ditemukan dalam beberapa asam amino, seperti: selenometionine, selenocysteine dan methylselenocysteine. Selenocysteine dan selenite direduksi menjadi hidrogen seleniuro.
Elektrolisis Tembaga
Tidak ada eksploitasi penambangan selenium. Sebagian besar diperoleh sebagai produk sekunder dari proses pemurnian dengan elektrolisis tembaga, berada di dalam lumpur yang menumpuk di anoda.
Langkah pertama terdiri dari produksi selenium dioksida. Untuk ini, anodik ramping dengan natrium karbonat diperlakukan untuk menghasilkan oksidasi. Kemudian selenium oksida ditambahkan air dan diasamkan untuk membentuk asam selenat.
Akhirnya, itu adalah asam selenous dengan sulfur dioksida untuk menghasilkan reduksinya dan mendapatkan selenium dasar.
Dalam metode lain dalam campuran lumpur dan lumpur yang terbentuk dalam produksi asam sulfat, selenium merah yang tidak murni diperoleh yang larut dalam asam sulfat.
Asam selenary dan asam selenat kemudian terbentuk. Asam seleni ini menerima perlakuan yang sama dengan metode sebelumnya.
Klorin juga dapat digunakan, yang bekerja pada seleniuros logam untuk menghasilkan senyawa klorinasi selenium yang mudah menguap; seperti: saya tahu2Cl2, Secl4, Secl2 dan seocl2.
Dapat melayani Anda: tingkat kimiaSenyawa ini, dalam proses yang dilakukan di dalam air, menjadi asam selenous, yang diobati dengan sulfur dioksida untuk melepaskan selenium.
Kertas Biologis
Kekurangan
Selenium adalah jejak penting untuk tanaman dan hewan, yang kekurangannya pada manusia telah menyebabkan gangguan serius seperti penyakit Keshan; Penyakit yang ditandai dengan kerusakan miokard.
Selain itu, defisiensi selenium dikaitkan dengan infertilitas pria dan dapat berperan dalam penyakit Kashin-Beck, sejenis osteoartritis. Demikian juga, defisiensi selenium telah diamati pada rheumatoid arthritis.
Kofaktor enzimatik
Selenium adalah komponen enzim dengan aksi antioksidan, seperti glutationa peroksidase dan tioresodoksin reduktase yang bertindak dalam penghapusan zat dengan oksigen reaktif.
Selain itu, selenium adalah kofaktor hormon tiroid desiodinases. Enzim ini penting dalam mengatur fungsi hormon tiroid.
Penggunaan selenium telah diindikasikan dalam pengobatan penyakit Hasimoto, penyakit autoimun dengan pembentukan antibodi terhadap sel tiroid.
Selenium juga telah digunakan untuk mengurangi efek toksik merkuri, karena beberapa tindakannya diberikan pada enzim antioksidan yang bergantung pada selenium.
Protein dan asam amino
Pria ini memiliki sekitar 25 seleenoprotein yang mengerahkan tindakan antioksidan untuk perlindungan terhadap stres oksidatif, diprakarsai oleh kelebihan spesies oksigen reaktif (ROS) dan spesies nitrogen reaktif (NI).
Kehadiran asam amino selenomethytheocin dan selenocysteine pada manusia telah terdeteksi. Selenomectionine digunakan sebagai suplemen makanan dalam pengobatan status defisiensi selenium.
Risiko
Konsentrasi tubuh selenium tinggi dapat memiliki banyak efek berbahaya pada kesehatan, dimulai dengan rambut rapuh dan kuku yang rapuh, untuk ruam kulit, panas, edema kulit dan nyeri parah.
Saat berhadapan dengan selenium yang bersentuhan dengan mata, orang dapat mengekspresikan semangat, iritasi dan air mata. Sementara itu, paparan asap yang berkepanjangan dengan kandungan selenium tinggi, dapat menyebabkan edema paru, napas bawang putih dan bronkitis.
Selain itu, orang tersebut mungkin mengalami pneumonitis, mual, kedinginan, demam, nyeri tenggorokan, diare dan hepatomegali.
Selenium dapat berinteraksi dengan obat -obatan lain dan suplemen makanan, seperti antasida, obat antineoplastik, kortikosteroid, niasin dan pil untuk kontrasepsi.
Selenium telah dikaitkan dengan peningkatan risiko tertular kanker kulit. Dalam sebuah penelitian oleh National Cancer Institute, ditunjukkan bahwa pria dengan konsentrasi tubuh selenium tinggi memiliki dua lebih dari kemungkinan menderita kanker prostat yang agresif.
Sebuah studi menunjukkan bahwa asupan harian 200 μg selenium, meningkat sebesar 50% kemungkinan mengembangkan diabetes tipe II.
Aplikasi
Kosmetik
Selenium sulphide digunakan dalam pengobatan seborrhea, serta lemak atau ketombe.
Dokter
Ini digunakan sebagai obat alternatif dalam pengobatan penyakit Hasimoto, penyakit tiroid autoimun.
Selenium mengurangi toksisitas merkuri, yang salah satu aktivitas beracunnya diberikan pada enzim deoksidan, yang menggunakan selenium sebagai kofaktor.
Elektrolisis Mangan
Penggunaan selenium oksida dalam elektrolisis mangan sangat mengurangi biaya teknik, karena konsumsi listrik berkurang.
Pigmen
Selenium digunakan sebagai pigmen dalam lukisan, plastik, keramik dan kaca. Tergantung pada selenium yang digunakan warna kaca bervariasi dari merah tua hingga oranye ringan.
Fotokonduktif
Karena sifat selenium abu -abu mengubah konduktivitas listriknya tergantung pada intensitas cahaya yang memancarkannya, selenium telah digunakan pada fotokopi, fotosiper, fotometer dan sel surya.
Penggunaan selenium pada fotokopi adalah salah satu aplikasi selenium utama; Tetapi penampilan fotokonduktor organik telah mengurangi penggunaannya.
Kristal
Selenium digunakan untuk perubahan warna kaca, sebagai akibat dari keberadaan besi yang menghasilkan warna hijau atau kuning. Selain itu, memungkinkan warna kaca merah, tergantung pada penggunaan yang ingin Anda berikan.
Pulkanisasi
Dietenio Dietenium digunakan sebagai agen vulkanisasi produk karet.
Paduan
Selenium digunakan dalam kombinasi dengan bismuth pada kuningan, untuk menggantikan timah; Elemen yang sangat beracun yang telah menurunkan penggunaannya karena rekomendasi dari agen kesehatan.
Selenium ditambahkan ke konsentrasi rendah pada paduan baja dan tembaga untuk meningkatkan kemudahan penggunaan logam ini.
Penyearah
Penyearah selenium mulai digunakan pada tahun 1933 hingga tahun 1970 -an, ketika mereka digantikan oleh silikon dengan biaya rendah dan kualitas lebih tinggi.
Referensi
- Royal Australian Chemical Institute. (2011). Selenium. [PDF]. Pulih dari: raci.org.Au
- Wikipedia. (2019). Selenium. Diperoleh dari: di.Wikipedia.org
- Sato Kentaro. (S.F.). Alotrop baru elemen grup utama. [PDF]. Diperoleh dari: Tcichemicals.com
- Kata. Dough Stewart. (2019). Fakta Elemen Selenium. Chemicool. Pulih dari: chemicool.com
- Robert C. Brazted. (28 Agustus 2019). Selenium. Encyclopædia Britannica. Dipulihkan dari: Britannica.com
- Marques Miguel. (S.F.). Selenium. Pulih dari: nautilus.Fis.UC.Pt
- Helmestine, Anne Marie, PH.D. (3 Juli 2019). Fakta Selenium. Pulih dari: thinkco.com
- Lentech b. V. (2019). Tabel Periode: Selenium. Pulih dari: lentech.com
- Tinggi u. (2008). Selenium: Perannya sebagai antioksidan dalam kesehatan manusia. Kesehatan lingkungan dan mencegah obat, 13(2), 102-108. Doi: 10.1007/S12199-007-0019-4
- Kantor Suplemen Diet. (9 Juli 2019). Selenium: Lembar Fakta untuk Profesional Kesehatan. Institut Kesehatan Nasional. Diperoleh dari: SDG.Od.Nih.Pemerintah

