Komponen solusi hipotonik, persiapan, contoh
- 866
- 182
- Joseph Nader PhD
A Solusi hipotonik Ini adalah salah satu yang menyajikan konsentrasi zat terlarut kecil sehubungan dengan larutan yang dipisahkan atau diisolasi oleh bug semipermeabel. Penghalang ini memungkinkan pelarut untuk transte, air dalam kasus sistem biologis, tetapi tidak semua partikel terlarut.
Cairan tubuh vertebrata intraseluler dan ekstraseluler memiliki osmolaritas sekitar 300 mosm/L. Sementara itu dianggap bahwa cairan hipotonik memiliki osmolaritas kurang dari 280 mosm/L. Jadi solusi osmolaritas ini hipotonik dalam kaitannya dengan media seluler.
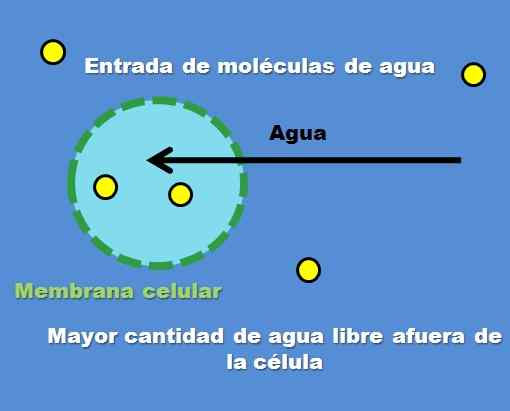
 Interaksi sel dengan solusi hipotonik. Sumber: Gabriel Bolívar.
Interaksi sel dengan solusi hipotonik. Sumber: Gabriel Bolívar. Contoh larutan hipotonik adalah 0,45% natrium klorida. Tetapi bagaimana sel atau kompartemen berperilaku di depan jenis solusi ini? Gambar superior menjawab pertanyaan ini.
Konsentrasi partikel zat terlarut (titik kuning) lebih tinggi di dalam sel luar. Memiliki lebih sedikit zat terlarut di sekitar sel, ada lebih banyak molekul air bebas, sehingga diwakili dengan warna biru yang lebih intens dibandingkan dengan interior sel.
Air mengalir keluar melalui osmosis ke konsentrasi tingkat. Akibatnya, sel mengembang atau kipas dengan menyerap air yang melintasi membran selnya.
[TOC]
Komponen solusi hipotonik
Solusi hipotonik terdiri dari pelarut yang, kecuali diindikasikan sebaliknya, terdiri dari air, dan zat terlarut yang dilarutkan di dalamnya seperti garam, gula, dll., dalam bentuk murni atau campuran. Tetapi solusi ini tidak akan memiliki tonisitas jika tidak ada penghalang semipermeable, yang menjadi membran sel.
Itu dapat melayani Anda: kalsium nitrat (ca (no3) 2)Harus ada beberapa garam terlarut sehingga konsentrasinya kecil, sedangkan "konsentrasi" airnya tinggi. Memiliki lebih banyak air bebas di luar sel, yaitu, tidak memecahkan atau melembabkan partikel zat terlarut, semakin besar tekanannya pada membran sel dan lebih banyak akan cenderung melintasinya untuk melemahkan cairan intraseluler.
Persiapan solusi hipotonik
Untuk persiapan solusi ini, protokol yang sama diikuti sebagai yang diikuti untuk solusi lain. Perhitungan yang tepat dari massa zat terlarut dibuat. Kemudian ini ditimbang, larut dalam air dan ambil bendera yang dibagikan ke volume yang sesuai dengannya.
Solusi hipotonik memiliki osmolaritas rendah, biasanya kurang dari 280 mosm/L. Jadi saat menyiapkan solusi hipotonik, kita harus menghitung osmolaritas Anda sedemikian rupa sehingga nilainya kurang dari 280 mosm/L. Osmolaritas dapat dihitung dengan persamaan berikut:
Osmolaritas = m · v · g
Di mana M Itu adalah molaritas zat terlarut, dan v Jumlah partikel di mana senyawa dipisahkan dalam larutan. Zat non -elektrolitik tidak terpisah, sehingga nilai v sama dengan 1. Ini adalah kasus glukosa dan gula lainnya.
Ketika G adalah koefisien osmotik. Ini adalah faktor koreksi untuk interaksi partikel bermuatan listrik (ion) dalam larutan. Untuk larutan encer dan zat non -disosiasi, misalnya dan sekali lagi glukosa, nilai g sama dengan 1 diambil. Kemudian dikatakan bahwa molaritas identik dengan osmolaritasnya.
Contoh 1
Siapkan larutan natrium klorida (NaCl) pada 0,5 % (p/v) memeriksa apakah itu solusi hipotonik atau tidak. Berat molekul NaCl = 58,5 g/mol.
Solusi 0,5 % gram NaCl per liter dilakukan:
Dapat melayani Anda: kalsium peroksida (cao2): sifat, risiko dan penggunaanNaCl dalam G/L = (0,5 g ÷ 100 ml) · 1.000 ml
= 5 g/l
Dan kami melanjutkan untuk menghitung molaritasnya dan kemudian menentukan osmolaritasnya:
Molaritas = massa (g/l) ÷ berat molekul (g/mol)
= 5 g/l ÷ 58,5 g/mol
= 0,085 mol/L
NaCl Disosiasi dalam dua partikel: NA+ (kation) dan cl- (Anion). Jadi nilai v = 2. Juga, karena merupakan larutan NaCl 0,5 %yang diencerkan, dapat diasumsikan bahwa nilai G (koefisien osmotik) adalah 1 adalah 1. KAMI MEMILIKI:
Osmolaritas (NaCl) = molaritas · v · g
= 0,085 m · 2 · 1
= 0,170 OSM/L O 170 mosm/L
Ini adalah solusi hipotonik, karena osmolaritasnya jauh lebih rendah daripada referensi osmolaritas untuk cairan tubuh yaitu osmolaritas plasma yang nilainya sekitar 300 mosm/l l.
Contoh 2
Siapkan larutan campuran kalsium klorida (CACL2) pada 0,055 % (p/v) dan glukosa (c6H12SALAH SATU6) pada 4 % (p/v). Berat molekul: CACL2 = 111 g/mol dan c6H12SALAH SATU6 = 180 g/mol.
Kami menghitung molaritas yang memiliki konsentrasi zat terlarut masing -masing pada 0,55 g/L dan 40 g/L:
Molaritas (CACL2) = 0,55 g/l ÷ 111 g/mol
= 4.95 · 10-3 M
= 4,95 mm
Molaritas (c6H12SALAH SATU6) = 40 g/l ÷ 180 g/mol
= 0,222 m
= 222 mm
Dan dengan cara yang sama kami menghitung osmolaritas, mengetahui bahwa klik2 Itu memisahkan tiga ion, dua cl- Dan ca2+, dan dengan asumsi bahwa mereka adalah solusi yang sangat encer, jadi nilai v Itu 1. Kita punya:
Osmolaritas (CACL2) = 4,95 mm · 3 · 1
= 14.85 mosm/l
Osmolaritas (c6H12SALAH SATU6) = 222 mm · 1 · 1
= 222 mosm/l
Akhirnya, osmolaritas total dari larutan menjadi jumlah osmolaritas individu; yaitu, dari NaCl dan glukosa. Karena itu ini:
Dapat melayani Anda: bahan refraktoriTotal osmolaritas larutan = CACL osmolaritas2 + Osmolaritas c6H12SALAH SATU6
= 222 mosm/l + 14.85 mosm/l
= 236.85 mosm/l
Larutan campuran kalsium dan glukosa klorida adalah hipotonik, karena osmolaritasnya (236,85 mosm/L) jauh lebih sedikit daripada osmolaritas plasma (300 mosm/L), yang diambil sebagai referensi.
Contoh solusi hipotonik
Larutan natrium klorida
0,45 % larutan natrium klorida diberikan secara intravena untuk pasien dengan ketosis diabetes yang mengembangkan dehidrasi di kompartemen interstitial dan intraseluler. Air mengalir dari plasma ke kompartemen tersebut.
Solusi laktat ringer
Ringer Lactate Solution No. 19 adalah contoh lain dari solusi hipotonik. Komposisinya adalah 0,6 g natrium klorida, 0,03 g kalium klorida, 0,02 g kalsium klorida, 0,31 g natrium laktat, dan 100 ml air suling. Ini adalah solusi yang digunakan untuk rehidrasi pasien dan sedikit hipotonik (274 mosm/L).
Referensi
- Dari lehr spilva, ke. Dan muktans, dan. (1999). Panduan untuk Spesialisasi Farmasi di Venezuela. Edisi XXXVª. Edisi Global.
- Whitten, Davis, Peck & Stanley. (2008). Kimia. (Edisi ke -8.). Pembelajaran Cengage.
- Wikipedia. (2020). Tonisitas. Diperoleh dari: di.Wikipedia.org
- Union Media LLC. (2020). Solusi isotonik, hipotonik, dan hipertonik. Diperoleh dari: UniontestPrep.com
- Lodish H, Berk A, Zipursky SL, dkk. (2000). Bagian 15.8osmosis, saluran air, dan regulasi volume sel. NCBI Bookshelf. Pulih dari: ncbi.Nlm.Nih.Pemerintah
- John Brennan. (13 Maret 2018). Cara menghitung isotonisitas. Pulih dari: ilmuwan.com
- « Matilde Hidalgo de Prince Biography, Kontribusi dan Pekerjaan
- 15 karakteristik teater terpenting »

