Aluminium sulfat (Al2 (SO4) 3)

- 4351
- 710
- Jessie Harvey
 Kristal aluminium sulfat putih
Kristal aluminium sulfat putih Apa itu aluminium sulfat?
Dia Aluminium sulfat Ini adalah garam aluminium formula anorganik untuk2(SW4)3, yang biasanya terjadi sebagai padatan putih kristal berkilau. Warna senyawa akan dipengaruhi oleh konsentrasi zat besi dan pengotor lainnya. Ada dua jenis utama aluminium sulfat: A dan B.
Ini adalah garam garam yang sangat larut, dan di alam jarang menemukannya dalam bentuk anhidratnya. Biasanya terhidrasi dalam bentuk aluminium sulfat octadecahydrate [ke2(SW4)3.18h2Atau] atau hexadecahydrate [ke2(SW4)3.16h2SALAH SATU].
Ini juga dapat membentuk garam ganda dengan kalium, dan dengan amonium, senyawa yang dikenal sebagai lampu. Sebagian ini mungkin karena afinitas air di dalam hidrat untuk mempertahankan ion lain, selain aluminium.
Struktur kimia aluminium sulfat
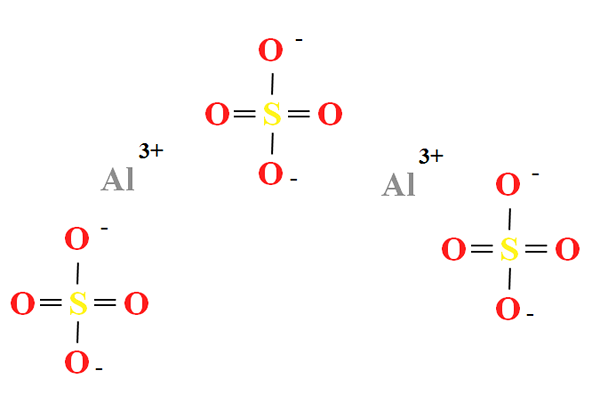 Struktur kimia aluminium sulfat. Sumber: Gabriel Bolívar
Struktur kimia aluminium sulfat. Sumber: Gabriel Bolívar Aluminium sulfat memiliki proporsi dua kation ke3+ untuk setiap tiga anion jadi42- (gambar superior), yang dapat diamati secara langsung dalam formula kimianya ke2(SW4)3.
Perhatikan itu3+ Mereka keabu -abuan, sedangkan SOS42- Mereka berwarna kuning (untuk atom belerang) dan merah (dengan atom oksigen).
Struktur yang diilustrasikan sesuai dengan bentuk Al anhidrat dari Al2(SW4)3, Karena tidak ada molekul air yang berinteraksi dengan ion. Namun, dalam hidratnya, air dapat ditarik ke pusat -pusat positif AL3+, atau untuk tetrahedra negatif dari begitu42- oleh jembatan hidrogen (hah-o-so32-).
Al2(SW4)3∙ 18h2Atau, misalnya, mengandung 18 molekul air dalam struktur padatnya. Beberapa dari mereka mungkin berhubungan langsung dengannya3+ atau dengan SOS42-. Dengan kata lain: Aluminium sulfat dapat memiliki air koordinasi internal atau eksternal.
Juga, strukturnya dapat menampung kation lain seperti iman3+, Na+, K+, dll. Tetapi untuk ini, kehadiran lebih banyak di bawah anion diperlukan42-, untuk menetralkan peningkatan beban positif karena kotoran logam.
Aluminium sulfat dapat memiliki banyak struktur, meskipun hidratnya cenderung mengadopsi sistem kristal monoklinik.
Sifat fisik dan kimia
Aspek
Itu disajikan sebagai padatan dengan kristal putih berkedip, butiran atau debu.
Berat molekul
342.31 g/mol (anhidrat).
Bau
Itu toilet.
Rasa
Rasa manis, cukup astringen.
Titik lebur
Bentuk 770º C Anhydra (bentuk 86,5º C octadecahydrate).
Kelarutan air
31.2 g/100 ml pada 0º C; 36,4 g/100 ml pada 20º C dan 89 g/100 ml pada 100º C.
Kepadatan
2.67 hingga 2.71 g/cm3.
Kelarutan
Sedikit larut dalam etil alkohol.
Tekanan uap
Pada dasarnya nol.
Stabilitas
Udara di udara.
Penguraian
Saat dipanaskan, kira -kira ke titik lelehnya, itu dapat dipecahkan dengan memancarkan terutama sulfur oksida, gas beracun.
Korosivitas
Larutan aluminium sulfat bersifat korosif untuk aluminium. Juga, senyawa dapat mengikat logam dengan adanya kelembaban.
Dapat melayani Anda: glukoneogenesisPKA
3.3 hingga 3.6. Dan pHnya 2,9 atau lebih dalam larutan berair di 5%.
Penggunaan aluminium sulfat
Koagulasi atau flokulasi air
- When mixed with water (potable, served or waste), aluminum sulfate causes aluminum hydroxide, which forms complex with compounds and particles in solution by accelerating its sedimentation, which in the absence of treatment with aluminum sulfate would take late a long time.
- Aluminium sulfat juga digunakan dalam membersihkan air kolam, membuatnya lebih menarik untuk digunakan.
- Melalui penggunaan aluminium sulfat, air tanpa kekeruhan dan warna tercapai, meningkatkan potabilitasnya dengan memfasilitasi pembersihan air. Sayangnya metode pemurnian ini dapat menyebabkan konsentrasi aluminium yang sedikit ditambah di dalam air.
- Aluminium adalah logam yang sangat beracun yang menumpuk di kulit, otak dan paru -paru, menyebabkan gangguan serius. Selain itu, tidak diketahui fungsi apa yang dipenuhi dalam makhluk hidup.
- Uni Eropa mensyaratkan bahwa batas maksimum aluminium di dalam air tidak melebihi 0,2 mg/L. Di sisi lain, Badan Perlindungan Enviromental AS menuntut agar batas polusi air maksimum dengan aluminium tidak melebihi 0,05-0,2 mg/L/L.
- Perawatan air yang digunakan atau disajikan dengan aluminium sulfat memungkinkan penghapusan atau pengurangan fosfor di dalamnya, secara ekonomi.
Saya menggunakan tinta mordant dan dalam elaborasi kertas
- Aluminium sulfat telah digunakan sebagai mordan pewarna atau tinta, membantu melihat materi tekstil. Tindakan perbaikannya adalah karena Al (OH)3, konsistensi agar -agar yang berkolaborasi dengan adsorpsi pewarna di atas tekstil.
- Meskipun telah digunakan dari sekitar 2000 hingga.C. Dengan tujuan yang dijelaskan, hanya pewarna organik yang membutuhkan mordan. Pewarna sintetis, di sisi lain, tidak mengharuskan mordan untuk memenuhi fungsinya.
- Itu telah dipindahkan dari pembuatan kertas, tetapi masih digunakan dalam elaborasi bubur kertas. Hapus kotoran Anda, serta telah digunakan untuk menghubungkan bahan, menetralkan beban dan mengkalibrasi kolofoni.
PENGGUNAAN INDUSTRA
- Ini digunakan dalam industri konstruksi untuk mempercepat pengaturan beton. Selain itu, digunakan dalam waterproofing konstruksi.
- Dalam industri sabun dan lemak digunakan dalam produksi gliserin.
- Dalam industri minyak, untuk elaborasi katalis sintetis yang mereka gunakan selama operasi mereka.
- Ini digunakan dalam industri farmasi sebagai astringen dalam persiapan obat -obatan dan kosmetik.
- Campur tangan dalam elaborasi pewarna seperti carmine. Ini juga digunakan sebagai pewarna dalam pembuatan stretus buttadiene karet sintetis.
- Di industri manufaktur gula digunakan sebagai pemurni molase tebu.
- Ini digunakan dalam pembuatan deodoran, karena menyebabkan penyempitan saluran saluran keringat, sehingga membatasi akumulasi keringat, cara yang diperlukan untuk pertumbuhan bakteri yang menyebabkan bau buruk.
- Ini digunakan dalam penyamakan kulit, suatu proses yang diperlukan untuk digunakan. Selain itu, digunakan dalam pembuatan pupuk.
- Ini digunakan sebagai aditif dalam elaborasi lukisan, perekat dan sealant, serta produk pembersihan dan kepedulian furnitur.
Penggunaan obat dan terapeutik
- Aluminium sulfat adalah adjuvan kekebalan. Oleh karena itu, itu memenuhi fungsi memproses antigen sedemikian rupa sehingga ketika mereka dilepaskan di tempat tindakan mereka, mereka menghasilkan produksi antibodi yang lebih besar untuk antigen yang diinokulasi.
- Adjuvant Freund dan BCG, serta adjuvan lainnya, termasuk endogen seperti interleukin, tidak spesifik untuk antigen, memungkinkan peningkatan jari -jari aksi kekebalan. Ini memungkinkan elaborasi vaksin terhadap banyak penyakit.
- Tindakan koagulan aluminium sulfat telah memungkinkan penghapusan banyak virus dalam air yang diolah, seperti beta, ms2, t4 dan p1, antara lain. Hasilnya menunjukkan bahwa perawatan air dengan aluminium sulfat menghasilkan inaktivasi virus tersebut.
- Aluminium sulfat digunakan di batang atau debu dalam pengobatan luka superfisial kecil atau lecet yang diproduksi dengan mencukur.
- Ini digunakan dalam pembuatan aluminium asetat, senyawa yang digunakan dalam pengobatan beberapa kondisi telinga. Ini juga telah digunakan, tanpa keberhasilan yang signifikan, untuk meringankan konsekuensi dari gigitan semut api.
- Larutan aluminium sulfat digunakan, pada konsentrasi 5% hingga 10%, dalam pengobatan lokal borok yang memungkinkan kontrol sekresi mereka.
- Tindakan astringen aluminium sulfat mengontrak lapisan permukaan kulit, protein koagulasi dan luka penyembuhan.
Penggunaan lainnya
- Aluminium sulfat membantu mengendalikan pertumbuhan ganggang yang berlebihan di kolam, danau dan arus air. Ini juga digunakan dalam penghapusan moluska, di antaranya, siput Spanyol.
- Tukang kebun menerapkan senyawa ini untuk mengasamkan tanah alkali. Berlakukan dengan air mereka, aluminium sulfat terurai dalam aluminium hidroksida dan asam sulfat encer. Kemudian, aluminium hidroksida endapan, sisa asam sulfat.
- Pengasaman tanah karena asam sulfat divisualisasikan dengan cara yang sangat kreatif, karena keberadaan tanaman yang disebut hydrangea, yang bunganya menjadi biru di hadapan tanah asam; yaitu, mereka sensitif dan menanggapi perubahan pH.
- Aluminium sulfat campur tangan dalam elaborasi busa untuk memerangi dan mengendalikan api: bereaksi dengan natrium bikarbonat, menghasilkan pelepasan CO2. Gas ini memblokir akses O2 ke situs pembakaran material, dan akibatnya penghentian api yang sedang dikembangkan.
Produksi aluminium sulfat
Aluminium sulfat disintesis dengan bereaksi senyawa yang kaya aluminium, seperti mineral bauksit, dengan asam sulfat pada suhu tinggi. Persamaan kimia berikut mewakili reaksi:
Ke2SALAH SATU3 + H2Sw4 -> Al2(SW4)3 + 3 h2SALAH SATU
Aluminium sulfat juga dapat terbentuk melalui reaksi netralisasi antara aluminium hidroksida dan asam sulfat, sesuai dengan reaksi berikut:
2 ke (oh)3 + 3 h2Sw4 + 12 jam2Atau -> ke2(SW4)3.18h2SALAH SATU
Asam sulfat bereaksi dengan aluminium untuk membentuk amonium sulfat dan pelepasan molekul hidrogen dalam bentuk gas. Reaksi ini ditsyaratkan sebagai berikut:
2 hingga +3 jam2Sw4 -> Al2(SW4)3 + 3 h2
Jenis Aluminium Sulfat
Aluminium sulfat diklasifikasikan menjadi dua jenis: Tipe A dan Tipe B. Dalam aluminium sulfat tipe A, padatan berwarna putih dan memiliki konsentrasi besi kurang dari 0,5%.
Dalam aluminium sulfat tipe B, padatan berwarna coklat dan memiliki konsentrasi besi kurang dari 1,5%.
Ada industri penghasil aluminium sulfat yang memiliki kriteria berbeda untuk klasifikasi. Dengan demikian, suatu industri melaporkan persiapan jenis aluminium sulfat ke konsentrasi maksimum 0,1% zat besi sebagai oksida besi.
Sedangkan untuk Tipe B, mereka menunjukkan konsentrasi zat besi maksimum 0,35%.
Toksisitas aluminium sulfat
- Aluminium sulfat adalah senyawa yang memberikan aksi toksiknya melalui kontak dengan debu, sehingga menyebabkan iritasi kulit, dan dalam kasus di mana kontak sering terjadi, dermatitis.
- Di mata itu menyebabkan iritasi yang kuat, bahkan menghasilkan cedera permanen.
- Inhalasinya menghasilkan iritasi pada hidung dan tenggorokan, yang dapat menyebabkan batuk dan carraspera.
- Asupannya menyebabkan iritasi lambung, mual dan muntah.
- Ada efek toksik yang meskipun tidak langsung disebabkan oleh aluminium sulfat, mereka secara tidak langsung untuk penggunaannya. Ini adalah kasus efek toksik tertentu dari aluminium, yang disebabkan oleh penggunaan aluminium sulfat dalam pemurnian air.
- Pasien yang secara kronis diaisasi menggunakan garam yang disiapkan dalam air murni melalui penggunaan aluminium sulfat, mengalami gangguan kesehatan yang sangat parah. Di antara gangguan ini kami menyebutkan anemia, demensia dialisis dan peningkatan penyakit tulang.
Referensi
- Wikipedia. (2018). Aluminium sulfat. Diambil dari: di.Wikipedia.org
- ARIS Industri. Aluminium sulfat tipe A dan B. Diambil dari: ARIS.com.pe
- Christopher Boyd. (9 Juni 2014). Penggunaan industri teratas untuk aluminium sulfat. Diambil dari: Chemservice.com
- Pubchem. (2018). Aluminium sulfat anhidrat. Diambil dari: pubchem.NCBI.Nlm.Nih.Pemerintah
- Andesia kimia. (20 Agustus 2009). Lembar Keselamatan Aluminium Sulfat. [PDF]. Diambil dari: Andesia.com
- Buku Kimia. (2017). Aluminium sulfat. Diambil dari: Chemicalbook.com

