Struktur, ManSo4) Struktur, Properti, Perolehan, Penggunaan

- 3981
- 218
- Ray Thiel
Dia Mangan Sulfat (II) Ini adalah padatan anorganik yang dibentuk oleh elemen mangan (Mn), sulfur (S) dan oksigen (O). Formula kimianya adalah MSO4. Bentuknya yang anhidrat (tanpa air dalam strukturnya) adalah padatan putih. Namun, ia memiliki beberapa bentuk terhidrasi dan semuanya adalah padatan merah muda.
Jumlah sulfat mangan dalam jumlah yang sangat kecil (kecil) digunakan sebagai mikronutrien untuk hewan dan manusia, karena diperlukan untuk fungsi normal organisme.
 Mangan sulfat anhidro mnso4. YOSF0113 di Bahasa Inggris Wikipedia / Domain Publik. Sumber: Wikimedia Commons.
Mangan sulfat anhidro mnso4. YOSF0113 di Bahasa Inggris Wikipedia / Domain Publik. Sumber: Wikimedia Commons. Ini juga ditambahkan bersama dengan pupuk tertentu di tanah yang kurang dalam mangan (MN) untuk tanaman pertanian yang membutuhkannya, seperti tanaman anggur.
Karena warna merah muda dari varietasnya yang terhidrasi, ia digunakan dalam pigmen yang berfungsi untuk melukis keramik, kain mewarnai dan bahan lainnya. Itu juga berfungsi untuk mendapatkan senyawa mangan lainnya.
Mons4 harus dimanipulasi dengan hati -hati. Inhalasinya dapat menyebabkan masalah pernapasan dan menghasilkan ketidaknyamanan yang serius dalam sistem saraf, yang meliputi gejala yang mirip dengan penyakit Parkinson.
Kelebihannya juga dapat menyebabkan kerusakan pada tanah dan hewan air dan tumbuhan.
[TOC]
Struktur
Anhidrat mangan sulfat (tanpa air dalam struktur kristalnya) dibentuk oleh ion mangan dalam oksidasi +2, yaitu MN2+ dan anion sulfat begitu42-.
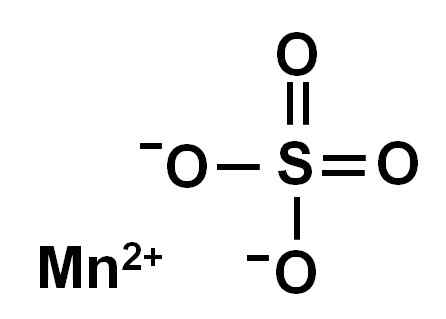 Struktur kimia sulfat mangan4. Penulis: Marilú Stea.
Struktur kimia sulfat mangan4. Penulis: Marilú Stea. Tata nama
- Mangan Sulfat (II)
- Mantosulfat mangan
- Mangan sulfat anhidro mnso4
- Mangan mangan mangan sulfat msso4 •H2SALAH SATU
- Tetrahidrat mangan sulfat mso4 •4H2SALAH SATU
- Pentahydrate sulfat mangan4 •5H2SALAH SATU
- Sulfat mangan hepthidrasi4 •7h2SALAH SATU
Properti
Keadaan fisik
Mons4 Anhydrous (tanpa air dalam strukturnya) adalah padatan putih kristal. Namun, varietas terhidrasi adalah padatan merah merah muda atau pucat.
 Manganeso sulfat tetrahidrat mnso4.4H2Atau solid merah muda. Benjah-bmm27 / domain publik. Sumber: Wikimedia Commons.
Manganeso sulfat tetrahidrat mnso4.4H2Atau solid merah muda. Benjah-bmm27 / domain publik. Sumber: Wikimedia Commons. Berat molekul
Msso4 = 151 g/mol
Msso4 •H2O = 169.02 g/mol
Titik lebur
MSSO anhidrat4 = 700 ºC
Monohydrate mso4 •H2O = 400-450 ° C
Menso Tetrahydrate4 •4H2O = 30 ° C
Titik didih
MSSO anhidrat4 = Ini terurai pada 850 ºC.
Itu dapat melayani Anda: kobalt klorida (cocl2 (: struktur, nomenklatur, sifatMenso Tetrahydrate4 •4H2O = 850 ° C
Kepadatan
Msso4 = 3.25 g/cm3
Msso4 •H2O = 2,95 g/cm3
Kelarutan
Sangat larut dalam air: 52 g/100 ml air pada suhu 5 ° C. Alkohol larut. Tidak larut dalam eter. Sedikit larut dalam metanol.
ph
Solusi Monse4 •H2Atau 5% memiliki pH 3,7.
Sifat kimia
Saat larut dalam air, MNSO4 dipisahkan menjadi ion Mn -nya2+ Dan sebagainya42-.
Ion Mangan (II) MN2+ Dalam larutan asam atau netral itu terkait dengan 6 molekul air2Atau membentuk ion hexaacuomangan [MN (h2SALAH SATU)6]2+, yang merah muda.
Ion hexaacuomangan [mn (h2SALAH SATU)6]2+ Ini cukup tahan terhadap oksidasi. Dalam media dasar (pH alkali) ion ini menjadi mangan hidroksida (II) Mn (OH)2, yang mudah teroksidasi, membentuk senyawa mangan (III) dan mangan (iv).
 Solusi MSSO4 Asam merah muda dengan adanya ion hexaacuomangan [Mn (h2SALAH SATU)6]2+. Penulis: Steve Cross. Sumber: Pixabay.Sulfat mangan memiliki beberapa bentuk terhidrasi, yaitu, dengan air h2Atau dalam struktur kristalnya.
Solusi MSSO4 Asam merah muda dengan adanya ion hexaacuomangan [Mn (h2SALAH SATU)6]2+. Penulis: Steve Cross. Sumber: Pixabay.Sulfat mangan memiliki beberapa bentuk terhidrasi, yaitu, dengan air h2Atau dalam struktur kristalnya.
Ini adalah monohydrate mso4 •H2Atau, tetrahidrat mso4 •4H2Atau, mnse pentahydrate4 •5H2O dan hepthydrate mso4 •7h2SALAH SATU. Bentuk -bentuk terhidrasi ini mengandung ion hexaacuomangan [Mn (h2SALAH SATU)6]2+ Dalam kristal mereka dan karena alasan ini mereka adalah padatan merah muda.
Menso monohydrate4 •H2Atau sedikit mekar, yang berarti kehilangan sebagian air hidrasi secara perlahan saat terpapar pada lingkungan.
Memperoleh
Mons4 dapat diperoleh dengan merawat mangan oksida (II) MnO, Mn Manghanous Hydroxide (OH)2 o mangan karbonat (ii) mnco3 Dengan asam sulfat h2Sw4.
Mnco3 + H2Sw4 → MSSO4 + H2Atau + co2
Aplikasi
Sebagai pelengkap gizi
Sulfat mangan dalam jumlah kecil melayani fungsi tertentu dari tubuh dan hewan manusia.
Itulah mengapa ini penting sebagai senyawa yang berguna dalam nutrisi dan disediakan sebagai suplemen makanan. Itu digunakan dalam jejak (jumlah yang sangat kecil).
Jumlah tinggi bisa sangat beracun dan berbahaya.
Dalam kedokteran hewan
Mons4 Burung Corral (ayam, kalkun, bebek dan phaisanes) diberikan untuk mencegah kekurangan atau kurangnya unsur mangan pada hewan ini.
Dapat melayani Anda: kalium iodat (kio3)Kurangnya mangan dimanifestasikan di dalamnya, misalnya, seperti penyakit yang disebut perosis, yang merupakan deformasi tulang kaki burung muda.
 Patitos mungkin memerlukan jejak Monste4 Dalam dietnya untuk mencegah perosis. Penulis: s. Hermann & F. Richter. Sumber: Pixabay.
Patitos mungkin memerlukan jejak Monste4 Dalam dietnya untuk mencegah perosis. Penulis: s. Hermann & F. Richter. Sumber: Pixabay. Ini berlaku untuk memberi makan burung -burung ini dalam jumlah atau jejak yang sangat kecil.
Di bidang pertanian
Sulfat mangan digunakan sebagai mikronutrien dalam pupuk untuk tanaman merambat (tanaman anggur) dan perkebunan tembakau di tangga yang kurang dalam mangan.
Namun, beberapa penelitian menunjukkan bahwa kelebihan mangan sulfat dapat menghambat atau mengurangi pembentukan enzim penting tertentu untuk pertumbuhan tanaman dan wabahnya.
 Dalam beberapa kasus itu berlaku MNSO4 ke tanah tempat tanaman anggur berada. Penulis: Schwoaze. Sumber: Pixabay.
Dalam beberapa kasus itu berlaku MNSO4 ke tanah tempat tanaman anggur berada. Penulis: Schwoaze. Sumber: Pixabay. Misalnya, telah ditemukan bahwa itu beracun bagi beberapa tanaman seperti kapas.
Mons4 Ini juga telah digunakan dalam fungisida dan bersama -sama dengan senyawa organik tertentu adalah bagian dari pestisida tertentu.
Dalam beberapa aplikasi
Mons4 Terhidrasi digunakan oleh pewarnaannya untuk menyiapkan pigmen anorganik yang digunakan dalam pernis merah untuk keramik, dalam kain dan pewarna bahan lainnya.
Sulfat mangan digunakan dalam pembuatan kaca dan sabun juga disiapkan dengannya.
 Beberapa ubin keramik dapat mengandung pigmen sulfat mangan. Penulis: Dwilliams. Sumber: Pixabay.
Beberapa ubin keramik dapat mengandung pigmen sulfat mangan. Penulis: Dwilliams. Sumber: Pixabay. Mons4 Ini adalah bahan awal untuk mendapatkan logam mangan (MN) secara elektrolitik, yaitu, dengan menerapkan listrik ke larutan berair.
Itu juga memungkinkan Anda untuk mendapatkan dioksida mangan2 dan karbonat mangan3.
Mons4 Ini juga digunakan untuk analisis kimia dan dalam formulasi solusi yang digunakan dalam percobaan genetika dengan mikroorganisme.
Risiko
Sulfat mangan mengandung ion mangan (II) (MN2+), yang dapat menjadi tidak berbahaya dan beracun tergantung pada jumlah yang diekspos orang, hewan atau tumbuhan.
Mangan sangat penting untuk fungsi normal organisme manusia, hewan dan beberapa tanaman. Tapi sayangnya mangan juga neurotoksik, yaitu, itu mempengaruhi sistem saraf dan beberapa fungsi tanaman.
Dapat melayani Anda: siapa yang merancang termometer modern pertama?Jumlah yang tampaknya aman
Mons4 Diberikan dengan makanan berbentuk makanan (jumlah yang sangat kecil atau kecil) umumnya aman dengan pemberian makanan dan pengobatan, atau FDA (akronim untuk bahasa Inggris Administrasi Makanan dan Obat -obatan).
Jumlah berbahaya
Paparan yang berkepanjangan atau berulang pada senyawa ini dalam jumlah yang cukup besar dapat menyebabkan kerusakan pada manusia dan hewan.
Ini menghasilkan iritasi pada mata lendir dan selaput lendir dari saluran pernapasan, anoreksia, sakit kepala, kehilangan keseimbangan, pneumonia dan infeksi pernapasan.
Inhalasi kronis menyebabkan kerusakan pada sistem saraf, menghasilkan manghanisme, getaran pada tangan dan gejala penyakit Parkinson yang khas.
 Mangan sulfat mempengaruhi sistem saraf. Penulis: Sabine Zierer. Sumber: Pixabay.
Mangan sulfat mempengaruhi sistem saraf. Penulis: Sabine Zierer. Sumber: Pixabay. Oleh karena itu, dispersi debu MSO harus dihindari4, Gunakan peralatan pernapasan dan sarung tangan pelindung.
Ini beracun bagi kehidupan akuatik dan dalam hal ini menghasilkan efek jangka panjang. Itu harus disimpan di tempat -tempat di mana tidak ada akses ke drainase atau sistem saluran pembuangan. Sangat penting untuk tidak membiarkannya dibuang di lingkungan.
Referensi
- ATAU.S. Perpustakaan Kedokteran Nasional. (2019). Sulfat Mangan. Pulih dari pubchem.NCBI.Nlm.Nih.Pemerintah.
- Ensiklopedia Kimia Industri Ullmann. (1990). Edisi Kelima. Volume A22. Vch verlagsgellschaft mbh.
- ATAU.S. Perpustakaan Kedokteran Nasional. (2019). Mangan sulfat monohidrat. Pulih dari pubchem.NCBI.Nlm.Nih.Pemerintah.
- Kapas, f. Albert dan Wilkinson, Geoffrey. (1980). Kimia anorganik canggih. Edisi keempat. John Wiley & Sons.
- Dunham, m.J. (2010). Panduan untuk Genetika Yast: Genomik Fungsional, Proteomik, dan Analisis Sistem Lainnya. Formulasi sedang. Dalam metode dalam enzimologi. Pulih dari scientedirect.com.
- Saric, m. dan Lucchini, R. (2007). Mangan. Kau gunakan. Dalam Buku Pegangan tentang Toksikologi Logam (Edisi Ketiga). Pulih dari scientedirect.com.
- Vallero, d. (2014). Efek neurologis dari polutan udara. Mangan. Dalam dana polusi udara (edisi kelima). Pulih dari scientedirect.com.
- Bersorak. (1986). In vitro Budaya Vitis: Efek spektrum cahaya mangan sulfat dan kalium iodida pada morfogenesis. Sel tanaman, tis dan organ kultus 7: 121-134 (1986). Tautan pulih.Peloncat.com.
- « Struktur Secbutil, Karakteristik, Nomenklatur, Pelatihan
- +125 ucapan pendek dan populer [dengan makna] »

