Struktur natrium sulfat (Na2SO4), sifat, penggunaan, mendapatkan

- 2288
- 426
- Mr. Darrell Streich
Dia sodium sulfat Itu adalah garam anorganik yang formula kimianya na2Sw4. Ini terdiri dari padatan putih, hadir dalam tiga bentuk: anhidrat, heptohidrat (dari sedikit keberadaan) dan dekayroper (yang dikenal sebagai garam glaubert); Yang terakhir adalah bentuk natrium sulfat yang paling berlimpah.
Sodium Sulfate Decayroyed, Na2Sw4· 10h2Atau, ditemukan pada tahun 1625 oleh Glaubert di air mata air, yang menunjuknya saltabilis (garam ajaib) karena sifat obatnya.
 Kaca jam dengan sampel natrium sulfat. Sumber: Walkerma via Wikipedia.
Kaca jam dengan sampel natrium sulfat. Sumber: Walkerma via Wikipedia. Sodium sulfat memiliki banyak aplikasi di industri tekstil dan kertas, serta dalam pembuatan kaca. Penggunaannya diperluas dengan aplikasi termal, yang meliputi pasokan panas lingkungan dan pendinginan laptop.
Sodium sulfat adalah senyawa toksisitas rendah dan tindakannya yang berbahaya, mereka pada dasarnya mekanis dan non -kimia. Untuk alasan kristalografi garam ini, seperti mitra poetassium, k2Sw4, menyajikan kerangka kerja dan struktur polimorfik.
[TOC]
Struktur
Garam anhidrat
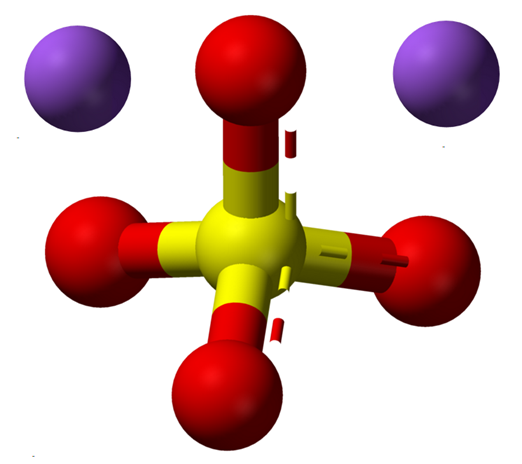 Ion natrium sulfat anhidrat. Sumber: Claudio Pistilli [CC BY-SA 4.0 (https: // createveCommons.Org/lisensi/by-sa/4.0)]
Ion natrium sulfat anhidrat. Sumber: Claudio Pistilli [CC BY-SA 4.0 (https: // createveCommons.Org/lisensi/by-sa/4.0)] Formula Na2Sw4 Menunjukkan setelah ion Na dalam kristal garam+ Dan sebagainya42- Mereka berada dalam hubungan 1: 2; yaitu, untuk setiap dua kation na+ ada anion jadi42- berinteraksi dengan mereka dengan daya tarik elektrostatik (gambar superior).
Tentu saja, ini berlaku untuk NA2Sw4 Anhidrat, tanpa molekul air yang dikoordinasikan dengan natrium di dalam kristal.
 Sodium sulfat
Sodium sulfat Meskipun merupakan penampilan sederhana, deskripsinya secara struktural itu rumit. Na2Sw4 Ini menyajikan polimorfisme, memiliki hingga lima fase kristal: I, II, III, IV dan V, yang suhu transisi masing -masing adalah 180, 200, 228, 235 dan 883 ºC.
Meskipun tidak ada referensi yang menyatakannya, NA2Sw4I Pasti yang memiliki struktur kristal heksagonal, lebih padat dibandingkan dengan ortorombik Na2Sw4Iii, di kristal NA siapa+ Bentuk tetrahedra (nao4) dan octahedros (nao6) koordinasi; yaitu, dapat dikelilingi oleh empat atau enam anion42-.
Decayedratada garam
Sementara itu, struktur kristal monoklinik dari hidratnya yang paling penting, Na2Sw4· 10h2Atau, lebih sederhana. Di dalamnya praktis adalah molekul air yang berinteraksi atau berkoordinasi dengan NA+ Di octahedra na (h2SALAH SATU)6+, Dengan begitu42- nyaris tidak berkontribusi stabilitas yang cukup pada kaca untuk ada dalam fase padat.
Itu dapat melayani Anda: revolusi kimia pertamaNamun, titik lelehnya (32,38 ºC) jauh lebih rendah daripada garam anhidrat (884 ºC) menunjukkan bagaimana molekul air dan jembatan hidrogennya melemahkan interaksi ionik, lebih kuat, dalam Na2Sw4.
Properti
Nama
-Sodium sulfat (IUPAC)
-Garam Glauber (dehidrasi)
-Sala Miraculous (Decayroper)
-Disodium sulfat.
Masa molar
142,04 g/mol (anh¡DRO)
322.20 g/mol (dekhidrat)
Penampilan fisik
Padatan kristal higroskopis putih
Bau
WC
Rasa
Pahit dan saline
Kepadatan
2.664 g/cm3 (anhidrat)
1.464 g/cm3 (Dahydrate)
Perhatikan bagaimana molekul air di dalam kristal menyebabkan mereka melebar dan, oleh karena itu, mengurangi kepadatannya.
Titik lebur
884 ºC (anhidrat)
32.38 ºC (Dechydrate)
Titik didih
1.429 ºC (anhidrat)
Kelarutan air
4,76 g/100 ml (0 ºC)
13.9 g/100 ml (20 ºC)
42,7 g/100 ml (100 ºC)
Semua nilai kelarutan sesuai dengan garam anhidrat, yang cukup larut dalam air di semua suhu.
Kelarutan meningkat secara tiba -tiba antara 0 ºC dan 38,34 ºC, mengamati bahwa dalam kisaran kelarutan suhu ini meningkat lebih dari 10 kali. Namun, dari kelarutan 32,38 ºC tidak tergantung pada suhu.
Kebetulan pada suhu 32,8 ºC Sodium sulfat yang rusak larut dalam air kristalnya sendiri. Oleh karena itu, keseimbangan antara garam dekayidrat, garam anhidra dan larutan jenuh natrium sulfat.
Selama kondisi tiga fase dipertahankan, suhu akan tetap konstan, yang memungkinkan suhu termometer untuk mengkalibrasi.
Di sisi lain, kelarutan untuk garam heptahidrat adalah:
19,5 g/100 ml (0 ºC)
44.0 g/100 ml (20 ºC)
Perhatikan bahwa pada 20 ° C garam heptahidrat tiga kali lebih larut daripada anhidrat.
Indeks bias
1.468 (anhidrat)
1.394 (dekhidrat)
Stabilitas
Stabil dalam kondisi penyimpanan yang disarankan. Tidak sesuai dengan asam dan basa yang kuat, aluminium dan magnesium.
Penguraian
Saat dipanaskan untuk dekomposisi, ia memancarkan asap beracun sulfur oksida dan natrium oksida.
ph
Solusi berair 5 % memiliki pH 7.
Reaktivitas
Sodium sulfat terdisosiasi dalam larutan berair dalam 2 Na+ Dan sebagainya42-, yang memungkinkan ion sulfat dikombinasikan dengan BA2+ Untuk mengendapkan barium sulfat. Praktis membantu memindahkan ion barium sampel air.
Dapat melayani Anda: transaminasiSodium sulfat menjadi natrium sulfida dengan reaksi pada suhu tinggi dengan batubara:
Na2Sw4 + 2 c => na2S +2 co2
Garam Glaubert, Naso4.10h2O Bereaksi dengan kalium karbonat untuk menghasilkan natrium karbonat.
Aplikasi
Industri Kertas
Sodium sulfat digunakan dalam pembuatan kertas bubur kertas. Ini digunakan dalam elaborasi kertas kraft, yang tidak mengandung lignin atau tunduk pada proses pemutihan, alasan yang memberikan perlawanan besar. Selain itu, digunakan dalam pembuatan kardus.
Deterjen
Ini digunakan sebagai bahan pengisian deterjen sintetis untuk digunakan di rumah, menambah deterjen untuk mengurangi tegangan permukaan.
Kaca
Ini digunakan dalam pembuatan kaca untuk mengurangi atau menghilangkan adanya gelembung udara kecil dalam kaca cair. Selain itu, menghilangkan pembentukan terak selama proses pemurnian kaca cair.
Industri tekstil
Sodium sulfat digunakan sebagai mordan, karena memfasilitasi interaksi pewarna dengan serat kain. Sodium sulfat detahidrasi digunakan dalam uji pewarna.
Selain itu, natrium sulfat digunakan sebagai zat pencetakan pewarna dan pewarna pewarna; seperti pewarna langsung, pewarna belerang dan agen lain yang mendukung pewarnaan kapas. Ini juga digunakan sebagai agen yang menunda pewarna sutra langsung.
Obat
Decahrid Sodium Sulfate digunakan sebagai pencahar, karena sedikit terserap di usus, dan karenanya tetap dalam terang hal ini menyebabkan peningkatan volume. Ini merangsang peningkatan kontraksi peristaltik yang menyebabkan pengusiran konten usus.
Sodium sulfat adalah penangkal untuk mengontrol keracunan dengan barium dan garam timbal. Garam Glaubert efektif untuk menghilangkan obat -obatan tertentu yang terlalu tertelan; Misalnya, parasetamol (acetoaminophen).
Selain itu, digunakan untuk memasok elektrolit yang buruk dengan kehadiran dalam larutan isoosmotik.
Agen pengeringan
Sodium sulfat karena merupakan reagen inert, digunakan untuk menghilangkan air dari larutan senyawa organik.
Bahan baku
Sodium sulfat digunakan sebagai bahan baku untuk produksi berbagai zat, termasuk: natrium sulfida, natrium karbonat dan amonium sulfat.
Dapat melayani Anda: kromatografi gasMemperoleh
Natrium sulfat diperoleh dengan ekstraksi pertambangan dan reaksi kimia.
Ekstraksi pertambangan
Ada tiga bijih atau mineral yang dieksploitasi dengan kinerja komersial: Thenardita (NA2Sw4), Mirabilita (na2Sw4· 10h2O) dan Glaubarita (NA2Sw4·Kasus4).
Di Spanyol, deposito dan mirabilita dieksploitasi oleh penambangan bawah tanah galeri dan pilar. Sementara itu, glauberita diperoleh di tempat terbuka, oleh rakit besar yang ditempatkan di tangki mineral.
Medan disiapkan dengan peledakan intensitas rendah untuk menghasilkan porositas yang memungkinkan pencucian natrium sulfat. Fase produksi terjadi dengan irigasi sprinkler dengan air tawar dari Glauberita, yang pencuciannya merambat dengan cara yang menurun.
Air garam natrium sulfat dikumpulkan, residu kalsium sulfat diisi.
Produksi Kimia
Sodium sulfat diperoleh selama produksi asam klorida melalui dua proses: proses mannheim dan proses hardgrenave.
Proses Mannheim
Ini dilakukan dalam oven baja besar dan dengan platform reaksi baja 6 m. Reaksi terjadi antara natrium klorida dan asam sulfat:
2 NaCl +H2Sw4 => 2 hcl +na2Sw4
Proses hardreave
Ini melibatkan reaksi natrium klorida, sulfur oksida, oksigen dan air:
4 NaCl + 22 + SALAH SATU2 + 2 h2O => 4 hcl +na2Sw4
Yang lain
Sodium sulfat terjadi dalam reaksi netralisasi antara natrium hidroksida dan asam sulfat:
2 NaOH +H2Sw4 => Na2Sw4 + H2SALAH SATU
Sodium sulfat adalah produk sampingan dari produksi berbagai senyawa. Itu diekstraksi dari limbah cair yang dikeluarkan selama produksi viscose dan selofan. Juga dalam produksi natrium dikromat, fenol, asam borat dan lithium karbamat.
Risiko
Sodium sulfat dianggap sebagai senyawa toksisitas rendah. Namun, itu dapat menghasilkan beberapa kerusakan pada orang yang menggunakannya tidak pantas.
Misalnya, Anda dapat menyebabkan iritasi mata, kemerahan dan rasa sakit. Di kulit dapat menyebabkan iritasi dan alergi pada beberapa orang. Konsumsinya dapat menyebabkan iritasi pada saluran pencernaan dengan mual, muntah dan diare. Dan akhirnya, inhalasinya menghasilkan iritasi di saluran pernapasan.
Referensi
- Shiver & Atkins. (2008). Kimia anorganik. (Edisi keempat). MC Graw Hill.
- Wikipedia. (2019). Sodium sulfat. Diperoleh dari: di.Wikipedia.org
- Pusat Nasional Informasi Bioteknologi. (2019). Sodium sulfat. Database pubchem. CID = 24436. Pulih dari: pubchem.NCBI.Nlm.Nih.Pemerintah
- B. N. Mehrotra. (1978). Struktur kristal na2Sw4AKU AKU AKU. Pulih dari: rruff-2.Geo.Arizona.Edu
- Glauberita-thenardita (natrium sulfat). [PDF]. Pulih dari: igme.adalah
- « Struktur seng oksida (ZnO), sifat, penggunaan, risiko
- Karakteristik Lactophenol Biru, Komposisi, Persiapan, Penggunaan »

