Struktur kalsium sulfida (CAS), sifat, memperoleh, menggunakan
- 1404
- 136
- Tommie Smith
Dia Kalsium sulfida Ini adalah padatan anorganik yang dibentuk oleh elemen kalsium (Ca) dan elemen sulfur, dari formula kimia adalah CAS. Ini adalah padatan putih yang kekuningan yang larut dalam air, yang ditemukan di alam di beberapa gunung berapi dan dalam beberapa meteorit dalam bentuk mineral yang disebut Oldhamite.
CAS saat larut dalam air membentuk berbagai senyawa karena ion sulfur s2- menjadi ion sh- dan oh ion terbentuk-. Solusi yang dihasilkan adalah alkali. Senyawa ini digunakan sebagai dasar untuk senyawa luminescent atau yang menghasilkan cahaya yang terlihat dalam kondisi tertentu. Bahan -bahan ini juga digunakan dalam lukisan ringan.
 CAS Kalsium sulfida telah ditemukan di beberapa meteorit. Penulis: рote жравёВ. Sumber: Pixabay.
CAS Kalsium sulfida telah ditemukan di beberapa meteorit. Penulis: рote жравёВ. Sumber: Pixabay. CAS telah dianggap sebagai obat yang mungkin untuk mengobati masalah jantung dan pembuluh darah seperti hipertensi atau tekanan tinggi, yang merupakan penyakit yang mempengaruhi sebagian besar populasi dunia.
Dengan kalsium sulfida senyawa lain seperti kalsium nitrat dan kalsium karbonat dapat diperoleh. Itu harus ditangani dengan hati -hati dan bersentuhan dengan kelembaban atmosfer dapat menghasilkan h2S yang sangat beracun.
[TOC]
Struktur
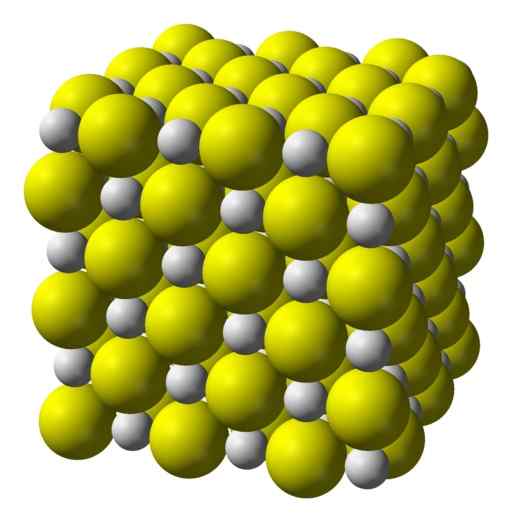
Kalsium sulfida adalah senyawa ionik yang sangat terbentuk oleh ion kalsium Ca2+ dan ion sulfida s2-.
Mengkristal dalam struktur kubik seperti garam batu.
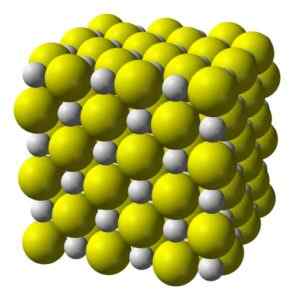 Struktur kristal kubik kalsium sulfida. Kuning = belerang; Putih = kalsium. Benjah-bmm27 / domain publik. Sumber: Wikimedia Commons.
Struktur kristal kubik kalsium sulfida. Kuning = belerang; Putih = kalsium. Benjah-bmm27 / domain publik. Sumber: Wikimedia Commons. Tata nama
- Kalsium sulfida
Properti fisik
Keadaan fisik
Kristal kristal putih kekuningan, kristal kubik seperti natrium klorida.
Berat molekul
72.144 g/mol
Titik lebur
2528 ºC
Kepadatan
2.59 g/cm3
Kelarutan
Larut dalam air. Tidak larut dalam etanol.
Sifat kimia
Larutan berair
Saat melarutkan air, CAS dipisahkan menjadi ion kalsiumnya 2+ dan sulfida s2-. Yang terakhir dalam air mengambil proton dan menjadi ion hydrosulfuro shh- melepaskan ion hidroksil oh-.
Dapat melayani Anda: diayakS2- + H2Atau ⇔ sh- + Oh-
Oleh karena itu, larutan kalsium sulfida adalah basa (mereka memiliki pH dasar) dan tidak memiliki ion S2- tapi sh-.
Hanya dalam hal sejumlah besar alkali ditambahkan ke larutan seperti naoh natrium hidroksida. Keseimbangan bergerak menuju pembentukan ion sulfur s2-.
 Kalsium sulfida larut dalam air yang membentuk senyawa lain. Penulis: clker-free-vector-images. Sumber: Pixabay.
Kalsium sulfida larut dalam air yang membentuk senyawa lain. Penulis: clker-free-vector-images. Sumber: Pixabay. Sh- Anda dapat mengambil proton lain h+ air, membentuk hidrogen sulfida, yang merupakan senyawa yang sangat beracun.
SH- + H2Atau ⇔ h2S + oh-
Oleh karena itu, sejumlah kecil bentuk H dalam air2S dan dengan terpapar kelembaban lingkungan, CAS mengeluarkan bau yang tidak menyenangkan yang khas dari hidrogen sulfida.
Senyawa hadir saat larut dalam air
Hasil dari reaksi air yang diindikasikan sebelumnya adalah bahwa CA (SH) terbentuk2, CA (OH)2 dan ca (sh) (oh).
Cas + h2O → CA (SH) (OH)
Ca (sh) (oh) + h2O → CA (OH)2 + H2S
Reaksi asam
Reaksi yang sama yang terjadi dalam air membuat CAS bereaksi dengan asam yang membentuk h2S.
CAS + 2 HCL → CACL2 + H2S
Reaksi lainnya
Jika larutan kalsium sulfida dengan sulfur dipanaskan, ion polisulfida diperoleh42- dan S32-.
Jika CAS dipanaskan di udara kering atau oksigen murni, senyawa ini dioksidasi menjadi kasing kalsium sulfit3 Dan kemudian ke case kalsium sulfat4:
2 cas + 3 o2 → 2 case3
2 case3 + SALAH SATU2 → 2 case4
Dengan agen pengoksidasi seperti KCLO kalium klorat3, Kno Potassium Nitrate3 atau timbal dioksida2 reaksi kekerasan terjadi.
Memperoleh
Kalsium sulfida dapat dibuat dengan mengkapir (pemanasan pada suhu yang sangat tinggi) kalsium (Ca) dan sulfur (s) di atmosfer lembam, yaitu, mereka tidak ada misalnya oksigen atau uap air.
Itu dapat melayani Anda: asam kloro (hclo2)CA + S + panas → CAS
Juga dapat diperoleh dengan memanaskan case kalsium sulfat4 Dengan batubara:
Kasus4 + 2 C → CAS + 2 CO2
Namun, dalam kasus terakhir, rumah murni tidak diperoleh, karena bereaksi juga dengan kasus ini4 membentuk cao dan sebagainya2.
CAS juga dihasilkan dengan membakar limbah batubara.
Kehadiran di alam
CAS secara alami hadir dalam mineral Oldhamite. Ini adalah komponen dari beberapa meteorit dan penting oleh penelitian ilmiah yang dilakukan pada tata surya.
Dipercayai bahwa Oldhamita dibentuk oleh kondensasi di nebula yang berasal dari tata surya. Itu juga ada di gunung berapi.
 Cas Calcsium Sulphide berada di Oldhamite Mineral, yang telah ditemukan di beberapa meteorit. Leon hupperichs/cc by-sa (https: // createveCommons.Org/lisensi/by-sa/3.0). Sumber: Wikimedia Commons.
Cas Calcsium Sulphide berada di Oldhamite Mineral, yang telah ditemukan di beberapa meteorit. Leon hupperichs/cc by-sa (https: // createveCommons.Org/lisensi/by-sa/3.0). Sumber: Wikimedia Commons. Selain itu, kalsium sulfida secara alami diproduksi oleh pengurangan kasus4 (plester) mungkin dengan aksi bakteri.
Aplikasi
Dalam bahan ringan
Salah satu penggunaan kalsium sulfida yang paling luas telah menjadi dasar untuk senyawa cahaya. Ini adalah zat yang memancarkan cahaya tampak dalam keadaan tertentu.
Dalam senyawa luminescent CAS, ini bertindak sebagai basis dan aktivator ditambahkan ke struktur seperti klorida elemen tertentu seperti Cerio (CE3+) dan Europio (UE2+).
Bahan yang dihasilkan dari CAS Union dan aktivator digunakan, misalnya, dalam layar tabung sinar katoda yang membentuk layar lama komputer atau komputer atau perangkat TV lama.
 Komputer kuno monitor memiliki tabung sinar katoda di mana kadang -kadang senyawa luminescent kalsium sulfida dan aktivator kadang -kadang digunakan. Penulis: Andreas160578. Sumber: Pixabay.
Komputer kuno monitor memiliki tabung sinar katoda di mana kadang -kadang senyawa luminescent kalsium sulfida dan aktivator kadang -kadang digunakan. Penulis: Andreas160578. Sumber: Pixabay. Mereka juga digunakan dalam lampu saat ini dari dioda pemancar cahaya, atau LED (akronim untuk bahasa Inggris Dioda pemancar cahaya).
Dapat melayani Anda: Ayaroína Lampu LED. Beberapa mungkin mengandung senyawa luminescent kalsium sulfida. Tidak ada penulis yang dapat dibaca mesin. Apper diasumsikan (berdasarkan klaim hak cipta). /Cc by-sa (http: // createveCommons.Org/lisensi/by-sa/3.0/). Sumber: Wikimedia Commons.
Lampu LED. Beberapa mungkin mengandung senyawa luminescent kalsium sulfida. Tidak ada penulis yang dapat dibaca mesin. Apper diasumsikan (berdasarkan klaim hak cipta). /Cc by-sa (http: // createveCommons.Org/lisensi/by-sa/3.0/). Sumber: Wikimedia Commons. Bahan -bahan ini juga digunakan dalam lukisan ringan dan pernis.
Dalam kedokteran
Kalsium sulfida telah dipertimbangkan dalam studi medis sebagai obat untuk mengobati hipertensi arteri (tekanan tinggi pada arteri). Ini adalah penyakit yang mempengaruhi sistem kardiovaskular banyak orang (jantung dan pembuluh darah).
Cas dianggap sebagai "donor" dari h2S. Ini memainkan peran penting dalam mengatur nada atau kekuatan pembuluh darah, sehingga pemberian CAS bisa menjadi obat yang mungkin untuk mengobati hipertensi.
 Kalsium sulfida telah dipelajari sebagai obat yang mungkin untuk tekanan tinggi dari sistem kardiovaskular orang sakit. Penulis: Mohamed Hassan. Sumber: Pixabay.
Kalsium sulfida telah dipelajari sebagai obat yang mungkin untuk tekanan tinggi dari sistem kardiovaskular orang sakit. Penulis: Mohamed Hassan. Sumber: Pixabay. Dalam memperoleh senyawa lain
Kalsium sulfida memungkinkan untuk menyiapkan senyawa lain seperti kalsium nitrat Ca (no3)2:
Cas + 2 hno3 → CA (Tidak3)2 + H2S
Ini juga telah digunakan untuk mendapatkan kalsium karbonat Caco3. Untuk ini, solusi CAS berair diajukan ke batubara2:
Cas + h2Atau + co2 → H2S + Caco3
Aplikasi lain
Kalsium sulfida juga digunakan sebagai aditif untuk pelumas dan sebagai zat flotasi dalam ekstraksi mineral.
Risiko
Kalsium sulfida dapat menyebabkan iritasi kulit, mata, dan saluran pernapasan. Harus dimanipulasi dengan tindakan pencegahan dan peralatan keamanan yang tepat.
Ini adalah senyawa yang sangat beracun untuk kehidupan air, jadi berbahaya bagi lingkungan ini.
Referensi
- Kapas, f. Albert dan Wilkinson, Geoffrey. (1980). Kimia anorganik canggih. Edisi keempat. John Wiley & Sons.
- Timah, d.R. (editor). (2005). Buku Pegangan Kimia dan Fisika CRC. 85th CRC Press.
- Ropp, r.C. (2013). Grup 16 (O, S, SE, TE) Senyawa Bumi Alkali. Kalsium sulfida. Dalam ensiklopedia senyawa bumi alkali. Pulih dari scientedirect.com.
- Li, dan.F. et al. (2009). Kalsium sulfida (CAS), untuk donor hidrogen sulfida (H (2) S): drarug antihipertensi baru baru? Med Hypothes, 2009 SEP; 73 (3): 445-7. NCBI pulih.Nlm.Nih.Pemerintah.
- Rumah j.DAN. dan rumah, k.KE. (2016). Sulfur, Selenium, dan Tellurium. Terjadi pada belerang. Dalam Kimia Anorganik Deskriptif (Edisi Ketiga). Pulih dari scientedirect.com.
- ATAU.S. Perpustakaan Kedokteran Nasional. (2019). Kalsium sulfida. Pulih dari pubchem.NCBI.Nlm.Nih.Pemerintah.
- Bir, m. et al. (2014). Konversi kalsium sulfida menjadi kalsium karbonat selama proses pemulihan sulfur unsur dari limbah gipsum. Limbah Manag, 2014 Nov; 34 (11): 2373-81. NCBI pulih.Nlm.Nih.Pemerintah.
- « Karakteristik Penelitian Kuantitatif, Teknik, Contoh
- Sifat kalsium silikat, struktur, memperoleh, penggunaan »

