Mekanisme dan contoh substitusi elektrofilik aromatik

- 4395
- 1107
- Jessie Harvey
Itu Substitusi elektrofilik aromatik (Sear) Ini adalah reaksi organik di mana spesies miskin dalam elektron, yaitu elektrofi, menggantikan salah satu hidrogen cincin aromatik. Reaksi ini bertentangan dengan penambahan yang diderita alkena, menunjukkan efek aromatik pada reaktivitas benzena dan turunannya.
Elektrofil, berkali -kali, dihasilkan selama mekanisme molekuler yang sama, produk campuran reagen dan katalis, yang terdiri dari asam Lewis, misalnya semua3 atau FECL3. Katalis ini meningkatkan aviditas elektrofil oleh elektron cincin aromatik, sehingga mempercepat reaksi.
 Dalam substitusi elektrofilik aromatik itu adalah cincin benzena yang menyerang elektrofil. Sumber: Gabriel Bolívar via Molview.
Dalam substitusi elektrofilik aromatik itu adalah cincin benzena yang menyerang elektrofil. Sumber: Gabriel Bolívar via Molview. Dalam gambar superior kita memiliki representasi sederhana dari serangan elektrofilik benzena terhadap elektrofil dan+. Perhatikan bahwa serangan itu berasal dari elektron dari salah satu ikatan rangkap; yaitu, elektron dari sistem π terkonjugasi yang memulai sear.
Reaksi ini memungkinkan benzena dan senyawa aromatik lainnya untuk mendapatkan substituen seperti kelompok OH, bukan2, Sw3H, cl, br, r, cor, coch3, diantara yang lain. Misalnya, fenol ini disintesis melalui Sear mulai dari benzena dan turunan lainnya.
[TOC]
Mekanisme substitusi elektrofilik aromatik
Langkah 1: Serangan Elektrofilik
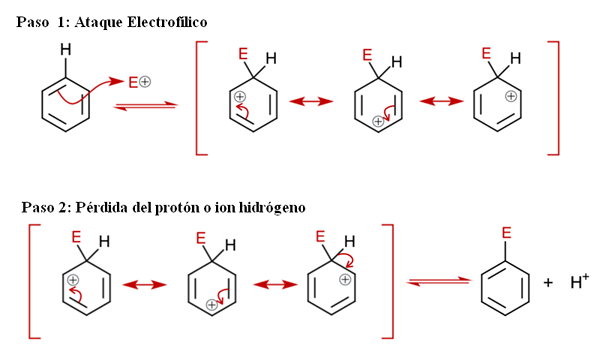 Mekanisme Umum untuk Sear. Sumber: Soonlorpai melalui Wikipedia.
Mekanisme Umum untuk Sear. Sumber: Soonlorpai melalui Wikipedia. Dalam gambar superior mekanisme substitusi elektrofilik aromatik diwakili secara lebih rinci. Salah satu dari tiga ikatan rangkap benzena menyerang elektrofil dan+, Untuk membentuk spesies perantara yang dikenal sebagai ion arenio (didelokalisasi sikloheksadien), terkunci dalam kurung merah.
Dapat melayani Anda: curah hujan kimiaPerhatikan bahwa beban positif E+ Sekarang pindah ke bagian dalam cincin. Tetapi tidak hanya itu: ia pindah antara tiga atom karbon dalam posisi ortho (berdekatan) dan untuk (berlawanan) dengan karbon yang terkait dengan E (C-E). Perantara ini ada tepatnya berkat stabilitas yang diberikan oleh struktur resonansi.
Langkah 2: Kehilangan proton atau ion hidrogen
Namun, ion areno harus segera menetralkan beban positifnya dengan kehilangan proton atau ion hidrogen. Di sinilah penggantian memuncak. Elektrofil e+ Oleh karena itu menggantikan salah satu hidrogen benzena, meninggalkan ini sebagai ion h+ di luar ring, sehingga biaya positif dipertahankan.
Jika diamati dengan hati -hati, semua langkah berada dalam keseimbangan, jadi penggantiannya reversibel. Yaitu, jika konsentrasi H meningkat+, maka hidrogen akan menggantikan E dan kami akan mendapatkan reagen lagi.
Contoh substitusi elektrofilik aromatik
Benzena
Sear benzena adalah yang paling sederhana, sudah diwakili di atas. Hidrogen mana pun dapat diganti dengan e+, Karena semuanya setara secara kimia.
Tidak ada perbedaan satu sama lain. Oleh karena itu, probabilitas bahwa penggantian terjadi di salah satu dari enam atom karbon adalah sama. Namun, semuanya berubah ketika ada substituen lain yang ada di cincin benzen, seperti yang akan kita lihat di bawah.
Fenol
Ortho, untuk dan serangan gawang
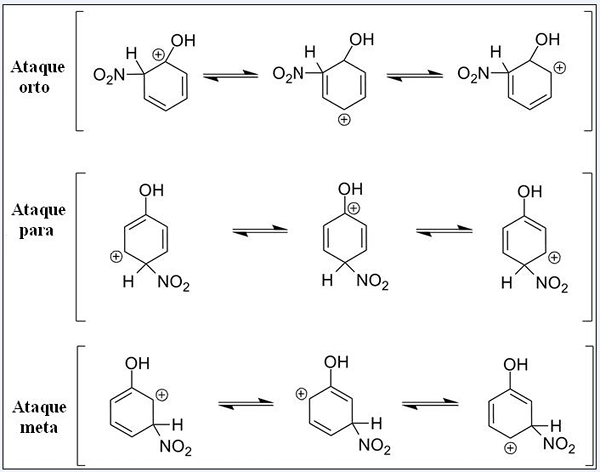 Struktur resonansi untuk fenol dalam reaksi substitusi elektrofilik aromatiknya. Sumber: Pete Davis, Domain Publik, Via Wikimedia Commons
Struktur resonansi untuk fenol dalam reaksi substitusi elektrofilik aromatiknya. Sumber: Pete Davis, Domain Publik, Via Wikimedia Commons Pertimbangkan sekarang sear untuk fenol. Kali ini, elektrofi adalah kation nitronia, bukan2+, yang saat menghubungkan ke cincin benzena diubah menjadi kelompok nitro, -tidak2.
Dapat melayani Anda: nitrat: properti, struktur, nomenklatur, pelatihanSekarang kelompok OH hadir, hidrogen lain berhenti setara secara kimia; Beberapa lebih rentan untuk diganti daripada yang lain. Dan di samping itu, oh memberikan pengaruh langsung pada saat ini.
Up kami memiliki tiga pengganti di posisi yang berbeda terkait dengan serangan OH: Ortho, untuk dan tujuan. Perhatikan bahwa dalam ketiganya kami memiliki kation berpasir dan struktur resonansi. Dalam serangan Ortho dan untuk, beban positif di dalam cincin benzena terletak tepat di karbon yang terkait dengan OH; Saat berada dalam serangan target, ini tidak terjadi.
Oh sebagai grup orto dan untuk sutradara
Oh menyajikan kemampuan untuk menghasilkan elektron ke cincin melalui resonansi dan induksi. Dalam keduanya, itu dapat membantu "menghilangkan" beban positif dalam karbon yang terkait, menstabilkan strukturnya sesuai. Sebaliknya, ketika serangan target terjadi, OH tidak dapat menstabilkan beban positif dengan cara yang sama, strukturnya lebih tidak stabil.
Oleh karena itu, serangan orto dan untuk lebih banyak energi disukai. Kemudian dikatakan bahwa OH adalah kelompok direktur orto-for, yang juga dapat mengaktifkan cincin benzenik menuju Sear. Yaitu, fenol bereaksi jauh lebih cepat daripada benzena, yang ditunjukkan dengan mengukur kecepatan reaksi.
Arilamin
 Struktur resonansi untuk anilin dalam reaksi substitusi elektrofilik aromatik. Sumber: V8Rik di Inggris Wikipedia, CC BY-SA 3.0, via Wikimedia Commons
Struktur resonansi untuk anilin dalam reaksi substitusi elektrofilik aromatik. Sumber: V8Rik di Inggris Wikipedia, CC BY-SA 3.0, via Wikimedia Commons Kasus arilamin, seperti anilin (gambar superior), mirip dengan fenol. Perhatikan bahwa dalam mekanismenya kali ini stabilisasi beban positif pada atom nitrogen (h2N+=), membantu substitusi berorientasi pada posisi orto dan untuk, seperti oh.
Ini dapat melayani Anda: Teori Bassat Asam: Arrhenius, Bronssted-Lowry, LewisSekarang, anilin lebih reaktif daripada fenol terhadap substitusi elektrofilik. Karena? Karena atom nitrogen kurang elektronegatif daripada oksigen, itulah sebabnya ia memberikan sepasang elektron bebas lebih mudah ke cincin aromatik. Oksigen, karena lebih elektronegatif, menghasilkan salah satu pasangan elektronnya dengan lebih sedikit "avidity".
Juga, jari -jari atom nitrogen lebih dekat dengan ukuran karbon. Ini berdampak pada fakta bahwa resonansi terjadi terutama antara atom dengan radio atau ukuran yang sama. Oleh karena itu, resonansi antara karbon dan nitrogen sedikit lebih stabil dan efisien daripada yang terjadi antara karbon dan oksigen.
Chlorobenzene
Di Chlorobenzene, di sisi lain, atom CL memperlambat substitusi karena elektronegativitasnya. Dan meskipun juga mampu menyumbangkan elektron karena resonansi terhadap cincin, jari -jari atomnya jauh lebih besar daripada karbon, oleh karena itu mengurangi kontribusi elektronik tersebut.
Sebagai tanggapan, klorobenzena bereaksi 50 kali lebih lambat dari benzena, karena cincinnya dinonaktifkan karena klorin. Dan juga, menarik elektron ke arah dirinya sendiri, klorin adalah kelompok sasaran, sehingga substitusi akan terjadi terutama di posisi itu.
Referensi
- Graham Solomons t.W., Craig b. Fryhle. (2011). Kimia organik. (10th Edisi.). Wiley Plus.
- Carey f. (2008). Kimia organik. (Edisi Keenam). MC Graw Hill.
- Morrison dan Boyd. (1987). Kimia organik. (Edisi Kelima). Addison-Wesley Iberoamericana.
- Wikipedia. (2020). Senyawa aromatik. Diperoleh dari: di.Wikipedia.org
- Ed Vitz et al. (8 September 2020). Hidrokarbon aromatik. Libretteks Kimia. Pulih dari: chem.Librettexts.org
- Wyman Elizabeth. (2020). Hidrokarbon Aromatik: Definisi, Contoh & Penggunaan. Belajar. Pulih dari: belajar.com
- Boluda, c. J., Macías, m., & González Marrero, J. (2019). Kompleksitas kimia bensin otomotif. Sains, teknik dan aplikasi,2(2), 51-79. Doi: doi.org/10.22206/CYAP.2019.V2i2.Pp51-79
- « Karakteristik energi termal, memperoleh, mentransfer
- Struktur aluminium oksida, sifat, penggunaan, nomenklatur »

