Tabel kuantum
- 2055
- 62
- Mr. Darrell Streich
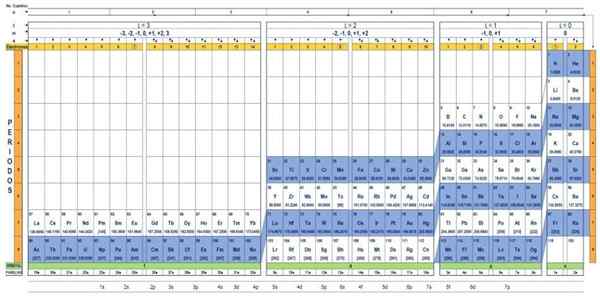
 Tabel kuantum elemen. Sumber: Unam.
Tabel kuantum elemen. Sumber: Unam. Apa tabel kuantum?
Itu Tabel kuantum Ini adalah cara untuk mengatur elemen kimia, yang dirancang untuk dengan mudah menentukan set angka kuantum yang menjadi ciri masing -masing.
Para ilmuwan telah menemukan bahwa, dalam sifat semua elemen, ada pola tertentu. Di antara pola -pola ini adalah angka kuantum, empat angka sederhana yang menggambarkan konfigurasi elektronik dari setiap elemen.
Angka kuantum muncul secara alami dari model mekanik mekanis atom dan dilambangkan dengan huruf: n, ℓ, mℓ dan S. Mereka menggambarkan status energi elektron dalam atom masing -masing elemen kimia.
Melalui tabel periodik tradisional, dan beberapa alat tambahan, dimungkinkan untuk memiliki konfigurasi elektronik atom dari elemen apa pun. Keuntungan dari tabel kuantum adalah bahwa elemen diatur sedemikian rupa sehingga angka kuantum mereka segera terlihat, tanpa perlu membuat banyak perhitungan secara terpisah.
Karakteristik tabel kuantum
Ada beberapa desain tabel kuantum. Model yang ditunjukkan pada gambar di atas berisi:
- Header dengan empat baris, dengan nilai empat angka kuantum, n, ℓ, m dan s, ditambah baris kelima dengan warna kuning, yang sesuai dengan jumlah elektron di orbital terluar paling.
- Tubuh meja, yang terdiri dari kisi -kisi yang berisi simbol elemen kimia, dimulai dengan hidrogen, di kolom kedua dari kanan, diikuti oleh helium, dan sebagainya. Jumlah di bawah ini mewakili jumlah elektron atom dalam keadaan mendasar.
- Di bagian bawah, di baris hijau ada empat kelas untuk mengatur elemen: orbital s, p, d dan f (dari kiri ke kanan).
- Akhirnya, di bawah baris orbital adalah keluarga. Setiap kolom adalah keluarga, bernomor dari 1 hingga 32. Misalnya, keluarga ke -1 dan ke -2 milik kelas S, keluarga dari 3 hingga 8a, milik kelas P, dan sebagainya.
Untuk apa tabel kuantum?
Tabel kuantum berfungsi untuk menemukan set angka kuantum yang menjadi ciri elektron dari atom. Biasanya, elektron -elektron ini akan menjadi lapisan terluar, karena mereka adalah yang menentukan perilaku kimia elemen.
Bagaimana tabel kuantum?
Tabel kuantum memungkinkan untuk dengan mudah menemukan angka kuantum elektron di lapisan terluar atom.
Contoh 1
Untuk mengilustrasikan prosedur, elemen aluminium diambil sebagai contoh, yang simbolnya adalah untuk. Langkah pertama adalah menemukannya di tabel kuantum, menandai dengan a lingkaran merah:
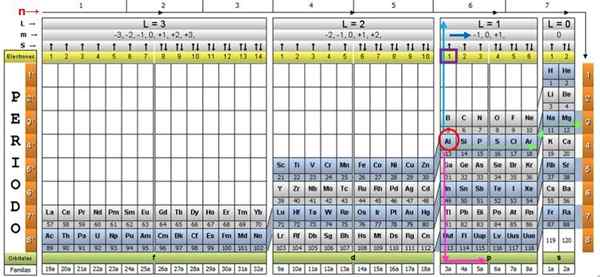
Langkah 1: Temukan n
Setelah menemukan elemen di tabel, Anda harus bergerak melalui baris dan warna yang sama, ke kanan, sampai Anda mencapai kolom oranye, mengikuti jalan panah hijau yang ditunjukkan pada gambar.
Panah menunjuk ke kotak yang ditandai dengan nomor 3, yang merupakan angka kuantum utama n:
n = 3
Langkah 2: Temukan ℓ
Untuk menentukan angka kuantum sekunder, panah vertikal biru diikuti, yang menunjukkan:
ℓ = 1.
Langkah 3: Temukan M
Elektron aluminium eksternal ditemukan di keluarga P pubilling, seperti yang dapat dibaca di baris hijau, yang menjadi titik panah merah muda.
Selain itu, jumlah elektron di lapisan terakhir dibaca di baris kuning header. Dalam kasus aluminium ada 1 elektron (disorot dalam kuadrat ungu), yang merupakan referensi. Menggabungkan hasil di atas, konfigurasi lapisan terakhir adalah:
Dapat melayani Anda: sel galvanik: bagian, cara kerja, aplikasi, contoh3p1
Diketahui bahwa lapisan P mendukung maksimal 6 elektron. Dan angka m mengambil sebagian dari keseluruhan nilai - ℓ, ( - ℓ+1), ... 0, ... (+ℓ −1),+ℓ.
Seperti dalam kasus ini ℓ = 1, maka m bisa −1, 0, 1.
Angka -angka ini muncul di baris header yang sesuai dengan M (lihat pada gambar Panah horizontal biru). Tabel berikut berfungsi sebagai panduan untuk mengetahui apa nilai memilih, tergantung pada kasusnya:
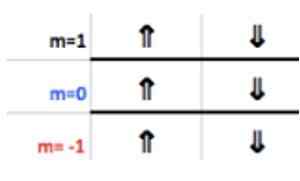
Karena lapisan aluminium terakhir memiliki 1 elektron, angka kuantum magnetik sesuai
M = 1.
Langkah 4: Temukan S
Nomor putaran hanya memiliki dua nilai: +½ atau - ½. Di kotak atas, jika panah menunjukkan ke atas, dipilih S = +½ dan jika menunjuk ke bawah, maka s = - ½. Dalam kasus aluminium, elektron 1 poin, oleh karena itu:
S = + ½.
Singkatnya, jumlah kuantum elektron lapisan terluar aluminium ke suara:
n = 3; ℓ = 1; M = 1, s = +½
Contoh 2 (kasus luar biasa)
AG perak, dan sekitar dua puluh lebih elemen, adalah kasus yang luar biasa, jadi perawatan harus diambil saat menggunakan tabel kuantum dengan mereka.
Jika prosedur sebelumnya diulang, AG akan diperoleh sebagai sub -level terakhir pada 4D9.
Ini karena konfigurasi yang diprediksi La Plata, oleh aturan Madelung, adalah:
1s2 2s2 2 p6 3S2 3p6 4s2 3d10 4p6 5S2 4d9
Namun, dalam praktiknya AG tidak mengikuti konfigurasi ini dengan tepat, juga tidak ada elemen lain yang lapisan terakhir yang diprediksi adalah 4D9, seperti tembaga dan emas, antara lain (berkonsultasi dengan internet untuk mendapatkan daftar elemen lengkap yang tidak mengikuti aturan Madelung).
Dapat melayani Anda: kebersihanKonfigurasi AG yang sebenarnya adalah:
1s2 2s2 2 p6 3S2 3p6 4s2 3d10 4p6 5S1 4d10
Di mana elektron lapisan 5S2 melompat ke lapisan 4D9 untuk menyelesaikannya. Dengan cara ini stabilitas atom meningkat. Oleh karena itu, sub -level terakhir benar -benar adalah:
5S1
Dan angka kuantumnya adalah yang sesuai dengan elemen RB, ditunjukkan dalam kotak ungu, dengan panah oranye yang menunjuk ke angka yang tersisa:
n = 5; ℓ = 0; m = 0; S = +½
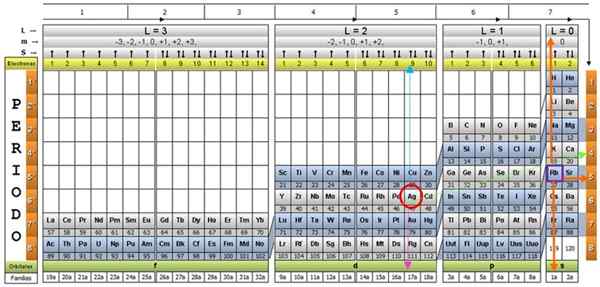 Meninjau tabel periodik, pada dasarnya terlihat bahwa Ag berada di periode 5, karakteristik yang ditentukan oleh angka kuantum utama n.
Meninjau tabel periodik, pada dasarnya terlihat bahwa Ag berada di periode 5, karakteristik yang ditentukan oleh angka kuantum utama n.
Perbedaan dengan tabel periodik
Kedua tabel adalah dua cara untuk mengatur elemen kimia sesuai dengan karakteristik atom mereka:
-Dalam tabel periodik, elemen yang ditemukan di kolom yang sama memiliki sifat kimia yang sama. Misalnya, itu dimulai dengan kolom logam alkali di sebelah kiri dan berakhir dengan gas mulia di sebelah kanan. Sedangkan di jajaran adalah elemen dengan tingkat energi yang lebih tinggi yang sama.
-Tabel kuantum memiliki disposisi loncatan, dirancang sesuai dengan aturan pengisian. Oleh karena itu, Anda harus mengikuti langkah -langkah untuk mendapatkan nomor kuantum utama, kecuali dalam kasus pengecualian seperti perak, dalam contoh bagian sebelumnya. Keluarga elemen dalam tabel ini terkait melalui orbital atas, di S, P, D atau F.
Referensi
- Chang, R. 2013. Kimia. 11va. Edisi. Pendidikan Bukit McGraw.
- Konfigurasi elektronik. Konfigurasi elektronik dan angka kuantum. Diperoleh dari: configuionectronica.com.
- Manual Kimia. Diperoleh dari: DCB.rekayasa.Unam.MX.
- Kimia Resmi. Cara mudah angka kuantum mudah. Diperoleh dari: Pejabat Kimia.com
- Triplenlace. Pengecualian untuk aturan Madelung dalam konfigurasi elektronik elemen kimia. Diperoleh dari: Triplenlace.com.

