Sejarah Teori Kinetik Molekuler, Deposulat dan Contoh

- 2848
- 368
- Herbert Fritsch
Itu Teori kinetik molekuler Ini adalah salah satu yang berupaya menjelaskan pengamatan eksperimental gas dari perspektif mikroskopis. Artinya, ia mencoba mengaitkan sifat dan perilaku partikel gas, dengan karakteristik fisik gas sebagai cairan; Jelaskan makroskopik dari mikroskopis.
Gas selalu menjadi objek yang menarik bagi para ilmuwan karena sifatnya. Mereka menempati seluruh volume wadah di mana mereka berada, mampu mengompres sepenuhnya tanpa konten mereka yang menentang resistensi yang lebih rendah; Dan jika suhu meningkat, wadah mulai berkembang, dan bahkan dapat retak.
 Partikel gas dalam kondisi jauh atau mendekati pencairan. Sumber: Olivier Cleynen dan Pengguna: Sharayanan [CC BY-SA 3.0 (https: // createveCommons.Org/lisensi/by-sa/3.0)]
Partikel gas dalam kondisi jauh atau mendekati pencairan. Sumber: Olivier Cleynen dan Pengguna: Sharayanan [CC BY-SA 3.0 (https: // createveCommons.Org/lisensi/by-sa/3.0)] Banyak dari sifat dan perilaku ini dirangkum dalam hukum gas ideal. Namun, mereka menganggap gas secara keseluruhan dan bukan sebagai satu set jutaan partikel yang tersebar di ruang angkasa; Selain itu, tidak memberikan, dari data tekanan, volume dan suhu, lebih banyak informasi tentang bagaimana partikel -partikel ini bergerak.
Begitulah teori kinetik molekuler (TCM), mengusulkan untuk memvisualisasikannya sebagai bidang seluler (gambar superior). Lingkungan ini bertabrakan satu sama lain dan dinding secara sewenang -wenang, dan mempertahankan lintasan linier. Namun, ketika suhu berkurang dan tekanan meningkat, lintasan bola menjadi kurva.
Gas, menurut TCM, harus berperilaku seperti bola kotak gambar pertama. Tapi, saat didinginkan dan meningkatkan tekanan pada mereka, perilaku mereka menjauh dari yang ideal. Mereka kemudian adalah gas asli, dekat dengan pencairan dan pergi ke fase cair.
Dalam kondisi ini, interaksi antara bidang menjadi lebih penting, sampai -sampai kecepatan mereka sesaat lambat. Semakin dekat mereka dari pencairan, semakin banyak kurva lintasan mereka (kotak kanan), dan tabrakan mereka lebih sedikit energi.
[TOC]
Sejarah
Daniel Bernoulli
Gagasan bidang -bidang ini, lebih baik disebut atom, telah dipertimbangkan oleh filsuf Romawi Lucretius; Bukan untuk gas, tetapi untuk benda yang kokoh dan statis. Di sisi lain, pada 1738 Daniel Bernoulli menerapkan penglihatan atom pada gas dan cairan dengan membayangkannya sebagai bidang yang tidak teratur yang bergerak ke segala arah.
Karyanya, bagaimanapun, melanggar hukum fisika pada waktu itu; Tubuh tidak bisa bergerak selamanya, jadi tidak mungkin untuk berpikir bahwa satu set atom dan molekul bertabrakan satu sama lain tanpa kehilangan energi mereka; yaitu, keberadaan tabrakan elastis tidak mungkin.
Rudolf Clausius
Satu abad kemudian, penulis lain memperkuat TCM dengan model di mana partikel gas bergerak ke satu arah. Rudolf Clausius, bagaimanapun, menyusun hasilnya dan mempersenjatai model TCM yang lebih lengkap yang ingin dijelaskan oleh hukum gase ideal yang ditunjukkan oleh Boyle, Charles, Dalton dan Avogadro.
Dapat melayani Anda: Coulombimetry: Fundamental, Jenis, AplikasiJames Clerk Maxwell dan Ludwig Boltzmann
Pada tahun 1859, James Clerk Maxwell menyatakan bahwa partikel gas menunjukkan berbagai kecepatan pada suhu tertentu, dan bahwa satu set mereka dapat dipertimbangkan dengan menggunakan kecepatan molekul rata -rata.
Kemudian, pada tahun 1871 Ludwig Boltzmann menghubungkan ide -ide yang ada dengan entropi, dan bagaimana secara termodinamik selalu cenderung menempati ruang maksimum yang mungkin terjadi dengan cara yang homogen dan spontan.
Teori Kinetik Molekul Postulat
Untuk mempertimbangkan gas dari partikelnya, model di mana postulat atau asumsi tertentu dipenuhi; dipostulatkan bahwa secara logis harus dapat memprediksi dan menjelaskan (setiu mungkin) pengamatan makroskopis dan eksperimental. Yang mengatakan, dalil TCM disebutkan dan dijelaskan.
Volume partikel gas dapat diabaikan
Dalam sebuah wadah yang penuh dengan partikel gas, mereka membubarkan dan menjauh di antara mereka melalui semua sudut. Jika sesaat mereka semua bisa bertemu pada titik tertentu dari wadah, tanpa pencairan, akan diamati bahwa mereka hampir tidak menempati sebagian volume wadah yang tercela.
Ini berarti bahwa dalam wadah, bahkan jika mengandung jutaan partikel gas, itu benar-benar lebih kosong daripada penuh (rasio volume-vacío jauh lebih sedikit dari 1); Karena itu, jika penghalangnya mengizinkannya, ia dan gas di dalam dapat dikompres secara tiba -tiba; Karena karena partikelnya sangat kecil, seperti volumenya.
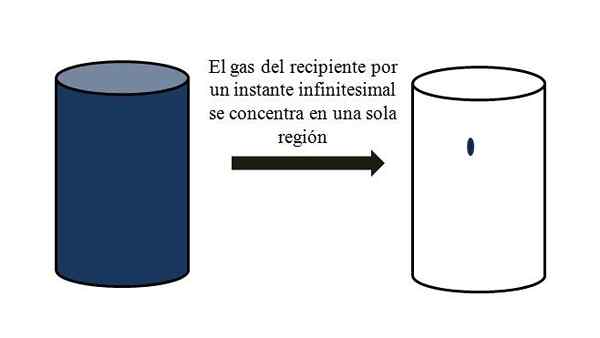 Volume-Vacío Hubungan gas dalam wadah. Sumber: Gabriel Bolívar.
Volume-Vacío Hubungan gas dalam wadah. Sumber: Gabriel Bolívar. Gambar superior secara tepat menggambarkan apa yang dikomentari di atas, menggunakan gas kebiruan.
Gaya tarik antara partikel adalah nol
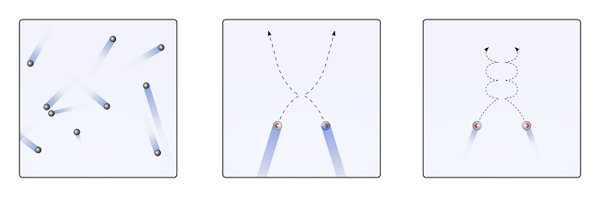
Partikel gas di dalam wadah bertabrakan satu sama lain tanpa waktu yang cukup untuk interaksi mereka menjadi kekuatan; Bahkan lebih sedikit ketika yang sebagian besar mengelilingi mereka adalah molekul kosong. Konsekuensi langsung dari ini adalah lintasan linier mereka memungkinkan mereka untuk sepenuhnya menutupi volume wadah.
Jika di atas tidak demikian, wadah "aneh" dan "labirin" akan memiliki daerah basah sebagai akibat dari kondensasi gas; Sebaliknya, partikel -partikel itu menempuh seluruh wadah dengan kebebasan penuh, tanpa kekuatan interaksi mereka menghentikannya.
Dapat melayani Anda: asam klorat (hclo3) Menghilangkan partikel gas saat interaksi nol atau tidak signifikan (ke., linear), dan ketika mereka penting (b., kurva). Sumber: Gabriel Bolívar.
Menghilangkan partikel gas saat interaksi nol atau tidak signifikan (ke., linear), dan ketika mereka penting (b., kurva). Sumber: Gabriel Bolívar. Lintasan linier gambar atas (a.) menunjukkan postulat ini; Sementara jika lintasan adalah kurva (b.), bukti bahwa ada interaksi yang tidak dapat diabaikan di antara partikel -partikel.
Partikel gas selalu bergerak
Dari dua postulat pertama bertemu selain itu fakta bahwa partikel gas tidak pernah berhenti bergerak. Setelah kabur di dalam wadah, mereka bertabrakan satu sama lain dan dengan dinding yang sama, dengan gaya dan kecepatan berbanding lurus dengan suhu absolut; Kekuatan ini, tekanannya.
Jika partikel gas berhenti bergerak sekitar sesaat, itu akan disaksikan di dalam "bahasa asap", timbul dari ketiadaan, dengan waktu yang cukup untuk memesan diri mereka dalam kekosongan dan memberikan cara acak.
Tabrakan antara partikel dan dinding wadahnya elastis
Jika tabrakan elastis antara partikel gas dan dinding wadah tidak akan pernah terjadi di dalam wadah, itu tidak akan pernah terjadi (sementara kondisi fisik tidak berubah) kondensasi gas; atau apa yang sama dengan mengatakan bahwa mereka tidak pernah beristirahat dan mereka selalu bertabrakan.
Ini karena dalam tabrakan elastis tidak ada kehilangan energi kinetik; Partikel bertabrakan dengan dinding dan memantul pada kecepatan yang sama. Jika sebuah partikel saat tabrakan mengurangi kecepatan, yang lain mempercepat, tanpa panas atau suara yang menghilangkan energi kinetik dari salah satu dari mereka.
Energi kinetik tidak tetap konstan
Pergerakan partikel itu acak dan kacau, sehingga tidak semua memiliki kecepatan yang sama; Seperti yang terjadi, misalnya, di jalan raya atau di tengah keramaian. Beberapa lebih energik dan bepergian lebih cepat, sementara yang lain lambat, menunggu tabrakan untuk mempercepatnya.
Untuk menggambarkan kecepatan Anda, kemudian perlu menghitung rata -rata; Dan dengan ini, energi kinetik rata -rata dari partikel atau molekul gas diperoleh. Karena energi kinetik dari semua partikel terus berubah, rata -rata memungkinkan kontrol data yang lebih baik dan Anda dapat bekerja dengan keandalan yang lebih besar.
Energi kinetik rata -rata sama dengan suhu yang diberikan untuk semua gas
Energi kinetik molekul rata -rata (ECMP) Dalam wadah itu dimodifikasi dengan suhu. Pada suhu yang lebih tinggi, energi ini akan lebih besar. Karena itu adalah rata -rata, mungkin ada partikel atau soda yang memiliki energi yang lebih besar atau lebih kecil sehubungan dengan nilai ini; Beberapa lebih cepat dan lebih lambat.
Dapat melayani Anda: asam dan basa: perbedaan, karakteristik, contohSecara matematis dapat ditunjukkan bahwa ECMP Itu tergantung secara eksklusif pada suhu. Ini berarti bahwa tidak peduli apa gas, massa atau struktur molekulnya, EC -nyaMP Itu akan sama pada suhu t dan hanya akan bervariasi jika meningkat atau berkurang. Dari semua postulat mungkin ini adalah yang paling relevan.
Dan bagaimana dengan kecepatan molekul rata -rata? Tidak seperti ECMP, Massa molekul memang mempengaruhi kecepatan. Semakin berat partikel atau molekul gas, wajar untuk berharap untuk bergerak lebih lambat.
Contoh
Di bawah ini adalah beberapa contoh singkat tentang bagaimana TCM telah berhasil memberikan penjelasan tentang hukum gas ideal. Meskipun tidak ditangani, fenomena lain, seperti penyebaran dan efusi gas, juga dapat dijelaskan dengan TCM.
Hukum Boyle
Jika volume wadah dikompresi pada suhu konstan, jarak yang harus dikejar partikel gas untuk bertabrakan dengan dinding berkurang; yang sama dengan peningkatan frekuensi tabrakan ini, menghasilkan tekanan yang lebih besar. Saat suhunya konstan, ECMP Itu juga konstan.
Hukum Charles
Jika t, EC meningkatMP akan meningkat. Partikel gas akan bergerak lebih cepat dan bertabrakan lebih banyak kali dengan dinding wadah; meningkatkan tekanan.
Jika dindingnya fleksibel, mampu mengembang, luasnya akan menjadi lebih besar dan tekanan akan jatuh sampai menjadi konstan; Dan sebagai hasilnya, volumenya juga akan meningkat.
Hukum Dalton
Jika beberapa liter gas yang berbeda ditambahkan dalam wadah yang luas, dari wadah yang lebih kecil, tekanan internal total mereka akan sama dengan jumlah tekanan parsial yang diberikan oleh masing -masing jenis gas secara terpisah.
Karena? Karena semua gas mulai bertabrakan satu sama lain dan membubarkan secara homogen; Interaksi di antara mereka batal, dan vakum mendominasi dalam wadah (postulat TCM), jadi seolah -olah masing -masing gas ditemukan sendiri, mengerahkan tekanannya secara individual tanpa gangguan gas lain.
Referensi
- Whitten, Davis, Peck & Stanley. (2008). Kimia. (Edisi ke -8.). Pembelajaran Cengage, P 426-431.
- Fernández Pablo. (2019). Teori kinetik molekuler. Vix. Pulih dari: vix.com
- Jones, Andrew Zimmerman. (7 Februari 2019). Teori gas molekuler kinetik gas. Pulih dari: thinkco.com
- Hall Nancy. (5 Mei 2015). Teori gas kinetik. Pusat Penelitian Glenn. Diperoleh dari: GRC.pot.Pemerintah
- Blaber m. & S. (9 Oktober 2018). Dasar -dasar teori molekuler kinetik. Libretteks Kimia. Pulih dari: chem.Librettexts.org
- Teori molekuler kinetik. Diperoleh dari: chemed.Chem.Purdue.Edu
- Wikipedia. (2019). Teori gas kinetik. Diperoleh dari: di.Wikipedia.org
- Toppr. (S.F.). Teori gas molekuler kinetik gas. Pulih dari: toppr.com

