Sistem Teori Tabrakan, Energi, Contoh
- 1665
- 127
- Tommie Smith
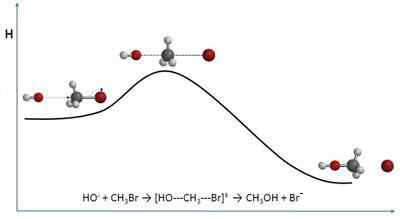
Itu teori tabrakan Jelaskan kecepatan reaksi kimia dari perspektif molekuler sekadar. Oleh karena itu sangat dekat dengan kinetika kimia. Alih -alih mendekati kecepatan dalam hal konsentrasi, ia melakukannya berdasarkan frekuensi tabrakan.
Saat berbicara tentang tabrakan, citra beberapa bola biliar dapat muncul di benak satu sama lain di atas meja. Namun, molekul, meskipun teori ini mengasumsikan bahwa bentuknya bulat, tidak berperilaku sama. Tabrakan molekuler berbeda dalam beberapa cara, baik spasial maupun energi.

Teori ini, meskipun dapat secara matematis sedikit kompleks dan menunjukkan variasi yang cukup besar mengenai hasil eksperimen, menawarkan gambar interpretasi yang terlihat dan tanpa aspek abstrak.
Meskipun diterapkan untuk sistem gas atau solusi yang sangat encer, prinsip -prinsipnya dapat meluas ke reaksi dan media fisik apa pun.
[TOC]
Kondisi reaksi terjadi
Menurut teori tabrakan ada tiga kondisi untuk terjadi reaksi:
- Spesies kimia (ion, molekul, radikal, dll.) Mereka harus bertabrakan secara efisien.
- Mereka harus membawa energi yang cukup untuk gangguan hubungan mereka.
- Selain itu, orientasi dampak harus sangat spesifik.
Tabrakan molekuler
 Seperti dalam bowling, reaksi hanya terjadi ketika tabrakan yang efisien terjadi dalam hal energi dan panduan
Seperti dalam bowling, reaksi hanya terjadi ketika tabrakan yang efisien terjadi dalam hal energi dan panduan Tabrakan molekuler berbagi kesamaan dengan makroskopis: mereka terjadi terutama antara dua spesies atau tubuh. Dua bola biliar bertabrakan satu sama lain, serta bola sepak bola di dinding, atau dua proyektil di tengah udara. Artinya, tabrakan sehubungan dengan kimia dan reaksinya cenderung tipe bimolekul.
Dapat melayani Anda: ionisasi dalam fisika dan kimia: konsep, proses dan contohMolekulnya tidak diam, tetapi mereka bergerak dan berputar melalui ruang yang mengelilinginya. Dengan melakukan itu, diasumsikan bahwa mereka menggambar semacam lingkaran yang disebut penampang, di mana ada kemungkinan molekul Colison lain. Demikian juga, teori ini menganggap bahwa molekul bersifat bola untuk menyederhanakan model matematika.
Dua molekul, hipotetis bulat, dapat bertabrakan tanpa masalah, bahkan jika tidak ada reaksi kimia. Tapi itu tidak terjadi dengan cara yang sama ketika datang ke tiga, empat atau lebih molekul.
Semakin banyak spesies yang harus mereka bertabrakan untuk berasal dari suatu produk, semakin tidak fenomena itu. Ini secara visual dijelaskan mencoba tiga bola atau proyektil bertabrakan secara bersamaan. Oleh karena itu, tabrakan bimolekul sejauh ini adalah yang paling umum.
Sistem
Teori tabrakan hanya valid untuk sistem atau fase perangkat lunak. Ini karena gas menunjukkan perilaku yang dapat dijelaskan dengan baik oleh kinetika mereka.
Untuk fase cair atau larutan yang sangat diencerkan, spesies reaktif dibungkus dalam kandang molekul pelarut, yang dengannya mereka juga bertabrakan. Ini memodifikasi panorama, karena reaksi tidak hanya tergantung pada frekuensi tabrakan, tetapi juga pada difusi molekul reaktan melalui medium.
Energi tabrakan
Molekul dapat bertabrakan perlahan atau sangat cepat. Ini tergantung pada seberapa besar energinya, yang pada gilirannya bervariasi secara signifikan dengan suhu. Semakin kuat tabrakan, probabilitas bahwa ada reaksi kimia akan meningkat, karena energi ini dapat memecahkan tautan yang diperlukan untuk membentuk yang baru.
Dapat melayani Anda: monomerEnergi ini dikenal sebagai aktivasi, danKE, Dan itu adalah karakteristik untuk reaksi kimia apa pun. Ketika suhu meningkat, rata -rata molekul mampu mencocokkan atau melebihi eKE, Jadi jumlah tabrakan yang efektif dan, oleh karena itu, produk terbentuk, meningkat.
Di hadapan katalis danKE berkurang, karena menyediakan permukaan dan elektronik berarti tabrakan manfaat itu. Hasilnya: Laju reaksi meningkat, tanpa meningkatkan suhu atau menambahkan reagen lainnya.
Faktor Sterik
Spesies kimia secara efektif bertabrakan untuk bereaksi, memprediksi teori ini apa yang akan menjadi kecepatan reaksi mereka. Namun, eksperimen telah menunjukkan bahwa semakin kompleks struktur reagen, semakin besar penyimpangan atau perbedaan antara kecepatan teoritis dan eksperimental.
Ini karena molekulnya jauh dari bola, tetapi secara spasial memiliki semua jenis geometri. Di sinilah faktor sterik masuk, ρ, dengan yang berupaya memperbaiki kecepatan reaksi sehingga prediksi teori dengan hasil eksperimen lebih baik.
Contoh reaksi
Reaksi bimolekul
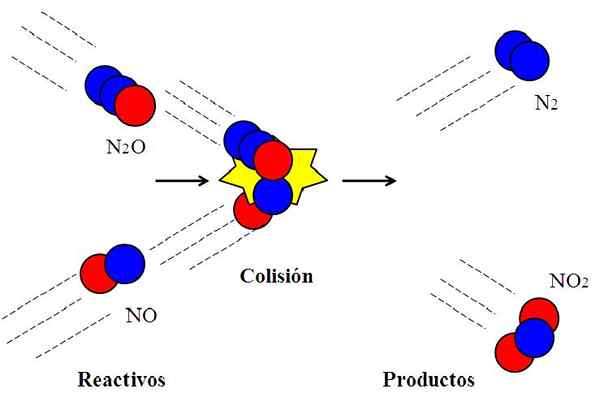 Tabrakan yang efektif antara nitrogen oksida. Sumber: Gabriel Bolívar.
Tabrakan yang efektif antara nitrogen oksida. Sumber: Gabriel Bolívar. Reaksi berikut:
N2O + no → n2 + TIDAK2
Biasanya digunakan untuk menjelaskan apa arti orientasi yang efektif dalam tabrakan molekuler.
Molekul n2Atau, dyitrogen oksida, tidak akan bereaksi dengan no, oksida nitrat, kecuali selama tabrakan atom oksigen (lingkaran merah) dari n2Atau guncangan langsung dengan atom nitrogen (lingkaran biru) dari NO. Hanya dengan cara ini produk n akan berasal2 dan tidak2; Kalau tidak, n molekul2O dan mereka tidak akan bangkit tanpa bereaksi.
Dapat melayani Anda: Gaseous State: Karakteristik, Hukum Umum, ContohIni adalah contoh tabrakan bimolekul untuk reaksi bimolekul dasar. Bahkan ketika reagen memiliki energi yang cukup untuk memecahkan tautan, jika orientasi tidak sesuai, tidak akan ada reaksi kimia.
Reaksi unimolekul
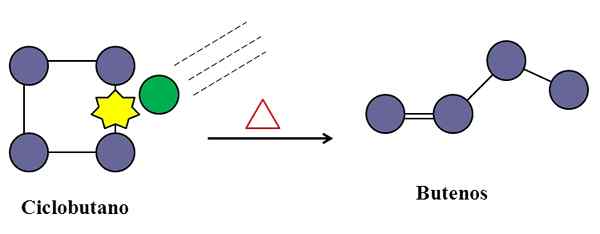 Tabrakan juga sangat diperlukan untuk isomerisasi siklobutan. Sumber: Gabriel Bolívar.
Tabrakan juga sangat diperlukan untuk isomerisasi siklobutan. Sumber: Gabriel Bolívar. Dalam reaksi dasar unimolekul, tabrakan molekuler juga dapat campur tangan, bahkan jika itu hanya spesies yang menderita transformasi atau kerusakan hubungannya.
Pertimbangkan misalnya isomerisasi cyclobutane untuk menimbulkan campuran butanes. Saat suhu meningkat, molekul siklobutan akan bergetar pada frekuensi yang lebih tinggi dan bertabrakan dengan gaya yang lebih besar. Namun, produk tersebut menunjukkan bahwa dua molekul siklobutan tidak bereaksi satu sama lain karena jika tidak, mereka akan menghasilkan senyawa dengan delapan karbon.
Di tengah mungkin ada kotoran (lingkaran hijau), yang juga bertabrakan dengan cyclobutane, khususnya pada salah satu tautan C-C-nya. Ini bisa berupa gas mulia, atau tidak terlalu reaktif molekul seperti nitrogen.
Akan tiba saatnya pengotor akan bertabrakan dengan energi yang cukup untuk memecahkan salah satu tautan C-C dari cyclobutane. Dan kemudian, molekulnya akan berupaya mengatur ulang dan berasal dari buutene, dikenali untuk ikatan rangkap dan struktur rantai liniernya.
Referensi
- Whitten, Davis, Peck & Stanley. (2008). Kimia. (Edisi ke -8.). Pembelajaran Cengage.
- Glasstone. (1970). Perjanjian fisikokimia. Aguilar s. KE. Edisi, Juan Bravo, 38, Madrid (Spanyol).
- Walter J. Moore. (1962). Kimia Fisik. (Edisi keempat). Longmans.
- Wikipedia. (2020). Teori tabrakan. Diperoleh dari: di.Wikipedia.org
- Para editor Eeritlopaedia Britannica. (2020). Teori tabrakan. Britannica Encyclopaedia. Dipulihkan dari: Britannica.com
- Clark Jim. (2018). Teori Colision Laju Reaksi. Pulih dari: chemguide.bersama.Inggris
- Lawson p. & S. (18 Mei 2020). Teori Colision. Libretteks Kimia. Pulih dari: chem.Librettexts.org
- « Karakteristik Teks Didaktik, Struktur, Jenis dan Contoh
- Negara -negara dan karakteristik Amerika Insular atau Antilles »

