Hukum Ketiga Rumus Termodinamika, Persamaan, Contoh
- 3439
- 12
- Dewey Runolfsdottir
Itu Hukum Termodinamika Ketiga menyatakan bahwa entropi sistem termodinamika tertutup dalam keseimbangan cenderung minim dan konstan, karena suhunya mendekati 0 Kelvin.
Nilai entropi ini akan independen dari variabel sistem (tekanan atau medan magnet yang diterapkan, antara lain). Apa yang terjadi adalah bahwa karena suhunya lebih dekat ke 0 K, proses dalam sistem dihentikan dan bagaimana entropi adalah ukuran agitasi internal, ia harus turun.
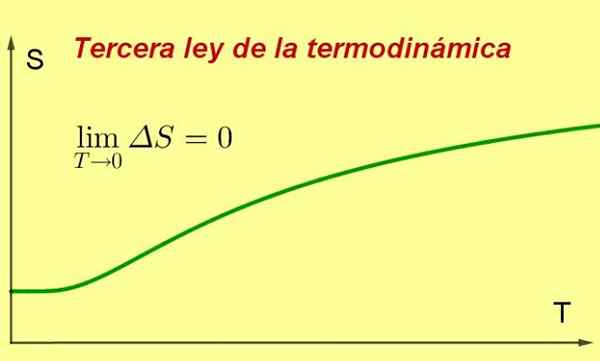
 Gambar 1. Saat suhu suatu sistem mendekati nol absolut, entropi mencapai nilai minimum dan konstan. Sumber: disiapkan oleh f. Zapata ..
Gambar 1. Saat suhu suatu sistem mendekati nol absolut, entropi mencapai nilai minimum dan konstan. Sumber: disiapkan oleh f. Zapata .. [TOC]
Konsep sebelumnya
Untuk memahami ruang lingkup hukum ketiga termodinamika, yang relevan dengan suhu yang sangat rendah, perlu meninjau konsep -konsep berikut:
Sistem termodinamika
Biasanya mengacu pada gas, cairan atau padatan. Apa yang bukan bagian dari sistem disebut sekitar. Sistem termodinamika yang paling umum adalah gas ideal, yang terdiri dari partikel N (atom) yang hanya berinteraksi melalui tabrakan elastis.
Sistem terisolasi, tertutup atau terbuka
Sistem yang terisolasi tidak diizinkan pertukaran dengan lingkungan. Sistem tertutup tidak bertukar materi dengan lingkungan tetapi panas. Akhirnya, sistem terbuka dapat menukar materi dan panas dengan lingkungan.
Makro -Status dan Microstate
Makro -status suatu sistem adalah himpunan nilai yang memiliki variabel: tekanan, suhu, volume, jumlah tahi lalat, entropi dan energi internal. Di sisi lain, harga mikro -dalam kasus gas ideal -diberikan oleh posisi dan momentum masing -masing partikel N yang mengada -ada, pada saat tertentu.
Banyak microstat dapat menghasilkan macro -state yang sama. Dalam gas pada suhu kamar, jumlah mikrostat yang mungkin sangat besar, karena jumlah partikel yang menebusnya, posisi yang berbeda dan berbagai energi yang dapat mereka adopsi sangat besar.
Rumus dan Persamaan
Entropi seperti yang kami katakan, adalah variabel makroskopik termodinamik yang mengukur sistem gangguan molekuler sistem. Tingkat gangguan suatu sistem lebih besar sejauh jumlah mikrostat yang mungkin lebih besar.
Konsep ini diperlukan untuk merumuskan hukum ketiga termodinamika dalam bentuk matematika. Baik itu entropi sistem, lalu:

Entropi adalah variabel keadaan makroskopis yang secara langsung terkait dengan jumlah kemungkinan mikrostat suatu sistem, dengan cara formula berikut:
S = k ln (w)
Dalam persamaan sebelumnya: S mewakili entropi, W jumlah kemungkinan mikrostat sistem dan k Itu adalah konstanta Boltzmann (K = 1.38 x 10-23 J/k). Yaitu entropi suatu sistem k kali logaritma alami dari jumlah microstate yang mungkin terjadi.
Perhitungan entropi absolut suatu zat
Dimungkinkan untuk mendefinisikan entropi absolut dari zat murni berdasarkan definisi variasi entropi:

ΔQ = n . CP .Dt
Di sini CP adalah panas molar spesifik dan n jumlah mol. Ketergantungan panas spesifik molar dengan suhu adalah fakta yang diperoleh secara eksperimental dan dikenal untuk banyak zat murni.
Dapat melayani Anda: Sistem Surya: Planet, Karakteristik, Asal, EvolusiMenurut hukum ketiga dalam zat murni:
=0)
=\int_0^T\frac\overlinec_pdTT)
Aplikasi
Dalam kehidupan sehari -hari, hukum termodinamika ketiga memiliki beberapa aplikasi, cukup bertentangan dengan hukum pertama dan kedua. Itu karena itu adalah prinsip yang mengacu pada apa yang terjadi dalam suatu sistem ketika mendekati 0 absolut, peringkat suhu langka.
Faktanya, mencapai absolut atau −273.15 ° C tidak mungkin (lihat Contoh 1 nanti) Namun, undang -undang ketiga diterapkan saat mempelajari respons bahan pada suhu yang sangat rendah.
Berkat ini, kemajuan penting dalam masalah kental telah muncul, seperti:
-Superfluiditas (lihat Contoh 2 nanti)
-Superkonduktivitas
-Teknik pendingin laser
-Kondensat Bose-Einstein
-Gas Fermi berlebihan.
 Gambar 2. Helium cair berlebihan. Sumber: Wikimedia Commons.
Gambar 2. Helium cair berlebihan. Sumber: Wikimedia Commons. Pada suhu yang sangat rendah, keturunan entropi memungkinkan munculnya fenomena kuantum yang menarik. Oleh karena itu, mari kita lihat apa yang terjadi dengan entropi sistem suhu yang sangat rendah.
Entropi sistem suhu rendah
Saat Anda memiliki zat kristal yang sempurna, entropi minimumnya persis nol, karena sangat rapi. Dalam suhu yang dekat dengan 0 absolut, materi dalam keadaan terkondensasi (cair atau padatan) dan getaran kaca minimal.
Beberapa penulis mempertimbangkan pernyataan alternatif dari hukum ketiga termodinamika berikut:
"Jika materi mengembun kristal yang sempurna, ketika suhu cenderung nol absolut, entropi cenderung tepat nol".
Mari kita tanda baca beberapa aspek dari pernyataan sebelumnya:
- Kristal yang sempurna adalah salah satu di mana setiap molekul identik dan di mana struktur molekul diulang secara identik secara keseluruhan.
- Karena suhu cenderung nol absolut, getaran atom hampir sepenuhnya berkurang.
Kemudian kaca membentuk satu kemungkinan konfigurasi atau mikro -statement, artinya W = 1, Dan karena itu entropi sama dengan nol:
S = k ln (1) = 0
Tapi tidak selama bahan yang didinginkan di dekat nol absolut membentuk kristal, apalagi kristal ini yang sempurna. Ini terjadi hanya jika proses pendinginan sangat lambat dan dapat dibalikkan.
Kalau tidak, faktor -faktor seperti kotoran yang ada dalam kaca akan memungkinkan keberadaan microstate lainnya. Oleh karena itu W> 1 dan entropi akan lebih besar dari 0.
Entropi residual
Jika proses pendinginan tiba -tiba, selama hal yang sama sistem melewati serangkaian keadaan non -keseimbangan, yang mengarah ke material untuk ditampilkan. Dalam hal ini, tidak ada struktur kristal dan tertib, tetapi padatan amorf, yang strukturnya mirip dengan cairan.
Dalam hal ini, nilai entropi minimum di sekitar nol absolut bukan nol, karena jumlah mikrostat jauh lebih besar dari 1. Perbedaan antara entropi ini dan entropi nol dari keadaan kristal sempurna dikenal sebagai entropi residual.
Penjelasannya adalah bahwa di bawah suhu ambang batas tertentu, sistem tidak memiliki kemungkinan lain selain menempati.
Ini dapat melayani Anda: Hukum Termodinamika Pertama: Rumus, Persamaan, ContohMereka akan bertanggung jawab untuk menjaga entropi konstan, bahkan jika suhu terus turun menuju absolute nol.
Contoh
Contoh 1: Zero absolut dan ketidakpastian Heisenberg
Prinsip ketidakpastian Heisenberg menetapkan bahwa ketidakpastian dalam posisi dan momentum partikel, misalnya dalam atom jaringan kristal, tidak independen dari yang lain, tetapi mengikuti ketidaksetaraan berikut:
Δx ⋅ Δp ≥ h
Dimana h adalah konstan Planck. Artinya, ketidakpastian dalam posisi dikalikan dengan ketidakpastian dalam momentum (massa per kecepatan) lebih besar dari atau sama dengan konstanta Planck, yang nilainya sangat kecil, tetapi tidak nol: H = 6.63 x 10-3. 4 J · s.
Dan apa hubungannya prinsip ketidakpastian dengan hukum termodinamika ketiga? Jika posisi atom dari jaringan kristal tetap dan tepat (Δx = 0) Maka kecepatan atom -atom ini dapat mengambil nilai apa pun antara 0 dan tak terbatas. Ini bertentangan dengan fakta bahwa dalam nol absolut, setiap gerakan agitasi termal berhenti.
Secara timbal balik, jika kita memulainya dengan nol suhu absolut, semua agitasi berhenti dan momentum setiap atom jaringan persis nol (ΔP = 0), maka prinsip ketidakpastian Heisenberg akan menyiratkan bahwa ketidakpastian dalam posisi masing -masing atom tidak akan terbatas, yaitu, mereka bisa berada di posisi apa pun.
Sebagai konsekuensi dari pernyataan sebelumnya, jumlah microstat akan cenderung tak terbatas dan entropi juga akan mengambil nilai tak tentu.
Contoh 2: Superfluiditas dan kasus aneh helium-4
Dalam berlebihan, yang terjadi pada suhu yang sangat rendah, materi kehilangan gesekan internal antara molekulnya, disebut zat yang lengket dan kental. Dalam hal ini, cairan bisa beredar tanpa gesekan selamanya, tetapi masalahnya adalah pada suhu itu hampir tidak ada yang cair kecuali helium.
Helium dan Helium 4 (isotopnya yang paling berlimpah) merupakan kasus yang unik, karena pada tekanan atmosfer dan pada suhu yang dekat dengan nol absolut, helium tetap cair.
Saat helium-4 diserahkan pada suhu di bawah 2.2 k pada tekanan atmosfer menjadi a tak berguna. Penemuan ini terjadi pada tahun 1911 di Leyden oleh fisikawan Belanda Heike Kamerlingh Onnes (1853-1926).
 Gambar 3. Fisikawan Belanda Heike Kamerlingh Onnes (1853-1926). Sumber: Wikimedia Commons.
Gambar 3. Fisikawan Belanda Heike Kamerlingh Onnes (1853-1926). Sumber: Wikimedia Commons. Atom helio-4 adalah a Bosón. Boson, tidak seperti fermion, adalah partikel yang dapat menempati semua keadaan kuantum yang sama. Oleh karena itu boson tidak memenuhi prinsip pengecualian Pauli.
Kemudian semua atom helium-4 pada suhu di bawah 2.2 K Menempati keadaan kuantum yang sama dan oleh karena itu tidak ada yang lebih dari satu mikrostat yang mungkin, menyiratkan bahwa helium-4 yang berlebihan memiliki s = 0.
Latihan terpecahkan
- Latihan 1
Pertimbangkan kasus sederhana yang terdiri dari suatu sistem yang hanya dibentuk oleh tiga partikel yang memiliki tiga tingkat energi. Untuk sistem sederhana ini:
a) Tentukan jumlah microstate yang mungkin untuk tiga rentang suhu:
-tinggi
-Setengah
-Rendah
b) Tentukan melalui entropi persamaan Boltzmann dalam rentang suhu yang berbeda.
c) mendiskusikan hasilnya dan menjelaskan apakah akan bertentangan dengan hukum termodinamika ketiga atau tidak.
Solusi untuk
Pada skala molekuler dan atom, energi yang dapat diadopsi oleh suatu sistem diukur, yang berarti bahwa hanya nilai diskrit tertentu yang dapat diambil. Selain itu, ketika suhu sangat rendah, partikel yang membentuk sistem hanya memiliki kemungkinan menempati tingkat energi yang lebih sedikit.
Itu dapat melayani Anda: induksi magnetik: formula, bagaimana itu dihitung dan contohnyaSuhu tinggi
Jika sistem memiliki suhu yang relatif tinggi, maka partikel memiliki energi yang cukup untuk menempati tingkat yang tersedia, sehingga menimbulkan 10 kemungkinan microstat, yang muncul pada gambar berikut:
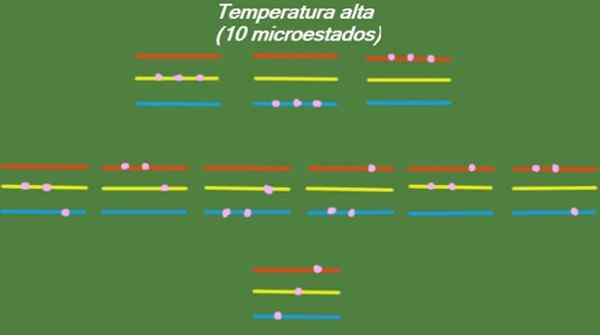 Gambar 4. Kemungkinan negara pada suhu tinggi untuk tahun ini diselesaikan 1. Sumber: disiapkan oleh f. Zapata.
Gambar 4. Kemungkinan negara pada suhu tinggi untuk tahun ini diselesaikan 1. Sumber: disiapkan oleh f. Zapata. Suhu sedang
Dalam hal sistem memiliki suhu menengah, maka partikel yang mengada -ada tidak memiliki energi yang cukup untuk menempati tingkat energi tertinggi. Kemungkinan microstat diilustrasikan dalam gambar:
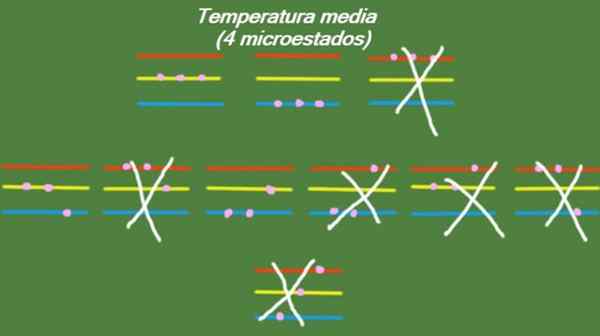 Gambar 5. Micro -state pada suhu rata -rata untuk sistem latihan terpecahkan 1. Sumber: disiapkan oleh f. Zapata.
Gambar 5. Micro -state pada suhu rata -rata untuk sistem latihan terpecahkan 1. Sumber: disiapkan oleh f. Zapata. Suhu rendah
Jika suhu terus turun dalam tiga partikel yang ideal dan tiga tingkat energi, maka partikel akan memiliki sedikit energi sehingga mereka hanya dapat menempati level terendah. Dalam hal ini, hanya ada 1 kemungkinan microstate, seperti yang dapat dilihat pada Gambar 6:
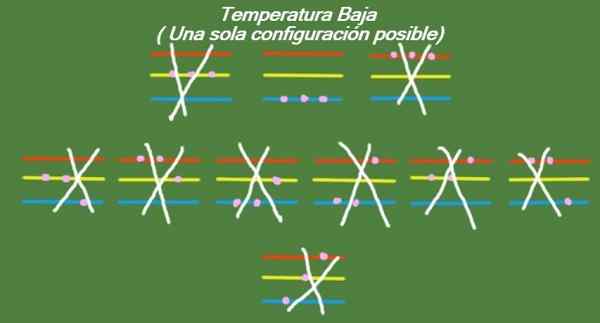 Gambar 6. Pada suhu rendah ada kemungkinan konfigurasi (elaborasi sendiri)
Gambar 6. Pada suhu rendah ada kemungkinan konfigurasi (elaborasi sendiri) Solusi b
Sudah diketahui jumlah microstat di setiap kisaran suhu, kita sudah dapat menggunakan persamaan Boltzmann yang diberikan sebelumnya untuk menemukan entropi dalam setiap kasus.
S = k ln (10) = 2.30 x k = 3.18 x 10-23 J/k (Suhu tinggi)
S = k ln (4) = 1.38 x k = 1.92 x 10-23 J/k (Suhu sedang)
Dan akhirnya:
S = k ln (1) = 0 (Suhu rendah)
Solusi c
Pertama -tama kita melihat bahwa entropi berkurang saat suhu turun, seperti yang diharapkan. Tetapi untuk nilai suhu terendah, nilai ambang tercapai, dari mana status dasar sistem tercapai.
Bahkan jika suhunya sedekat mungkin dengan nol mutlak, tidak ada negara yang lebih kecil yang tersedia. Kemudian entropi mempertahankan nilai minimum konstannya, yang dalam contoh kami adalah S = 0.
Latihan ini menggambarkan, pada tingkat mikrostat suatu sistem, alasan mengapa hukum termodinamika ketiga terpenuhi.
- Latihan 2
Alasan jika pernyataan berikutnya benar atau salah:
"Entropi suatu sistem pada suhu absolut nol persis nol".
Membenarkan jawabannya dan menjelaskan beberapa contoh.
Larutan
Jawabannya adalah: Salah.
Pertama -tama suhu absolut tidak dapat dicapai karena prinsip ketidakpastian Heisenberg dan hukum ketiga termodinamika akan dilanggar.
Sangat penting untuk mengamati bahwa dalam hukum ketiga tidak dikatakan apa yang terjadi di absolut 0, tetapi ketika suhunya sangat dekat dengan absolut 0. Perbedaannya halus, tetapi signifikan.
Undang -undang ketiga tidak menegaskan bahwa ketika suhu mengambil nilai secara sewenang -wenang dekat dengan nol absolut, entropi cenderung nol. Ini hanya akan terjadi dalam kasus yang dianalisis sebelumnya: kristal sempurna, yang merupakan idealisasi.
Banyak sistem skala mikroskopis, yaitu pada skala kuantum, memiliki tingkat dasar energi mereka merosot, Apa artinya keberadaan beberapa konfigurasi di tingkat energi terendah.
Di atas berarti bahwa dalam sistem ini entropi entropi tidak akan pernah menjadi nol. Entropi juga tidak akan menjadi nol dalam sistem yang dianut ketika suhu cenderung menjadi nol absolut. Dalam hal ini, entropi residual Sebelum terlihat.
Itu karena molekul mereka "macet" sebelum mereka menempati tingkat energi terendah yang tersedia, yang sangat meningkatkan jumlah kemungkinan mikrostat, sehingga tidak mungkin bahwa entropi persis nol.
Referensi
- Cengel, dan. 2012. Termodinamika. Edisi ke -7. Bukit McGraw. 347.
- Laboratorium Propulsi Jet. Tempat paling keren di alam semesta. Pulih dari: coldatomlab.Jpl.pot.Pemerintah.
- González, a. Entropi dan spontanitas. Pulih dari: geocities.WS
- Quora. Apa penggunaan praktis hukum ketiga termodinamika?. Pulih dari: quora.com
- Kimia Umum. Prinsip Ketiga Termodinamika. Pulih dari: Korintus.PUCP.Edu.pe
- Hukum Termodinamika Ketiga. Dipulihkan dari: YouTube.com
- Wikipedia. Residu entropi. Diperoleh dari: di.Wikipedia.com
- Wikipedia. Hukum Termodinamika Ketiga. Diperoleh dari: di.Wikipedia.com
- « Kecelakaan apa yang paling sering terjadi pada anak -anak dan orang dewasa?
- Struktur asam trikloroasetat, sifat, sintesis, penggunaan, efek »

