Kimia panas

- 1247
- 168
- Domingo Gutkowski
Kami menjelaskan bahwa itu adalah termokimia, studi apa, hukum dan aplikasinya
 Dalam termokimia, modifikasi panas dipelajari dalam reaksi kimia
Dalam termokimia, modifikasi panas dipelajari dalam reaksi kimia Apa itu termokimia?
Itu Kimia panas Ini bertanggung jawab untuk studi modifikasi panas yang dilakukan dalam reaksi antara dua atau lebih spesies kimia. Ini dianggap sebagai bagian penting dari termodinamika, yang mempelajari transformasi panas dan jenis energi lainnya untuk memahami arah di mana proses dikembangkan dan bagaimana energinya bervariasi.
Penting juga untuk memahami bahwa panas melibatkan transfer energi termal yang terjadi antara dua benda, ketika ini berada pada suhu yang berbeda; Sementara energi termal dikaitkan dengan gerakan acak yang dimiliki atom dan molekul.
Oleh karena itu, karena hampir semua reaksi kimia, energi diserap atau dilepaskan melalui panas, analisis fenomena yang terjadi melalui termokimia sangat relevan.
Studi apa termokimia?
Termokimia mempelajari perubahan panas dalam bentuk panas yang terjadi dalam reaksi kimia atau ketika proses yang menyiratkan transformasi fisik terjadi.
Dalam hal ini, konsep -konsep tertentu harus diklarifikasi dalam subjek untuk pemahaman yang lebih besar tentang hal yang sama.
Sistem
Misalnya, istilah "sistem" mengacu pada segmen spesifik dari alam semesta yang sedang dipelajari, dipahami sebagai "alam semesta" pertimbangan sistem dan sekitarnya (segala sesuatu yang eksternal dari ini).
Jadi, suatu sistem umumnya terdiri dari spesies yang terlibat dalam transformasi kimia atau fisik yang terjadi dalam reaksi. Sistem ini dapat diklasifikasikan menjadi tiga jenis: terbuka, tertutup dan terisolasi:
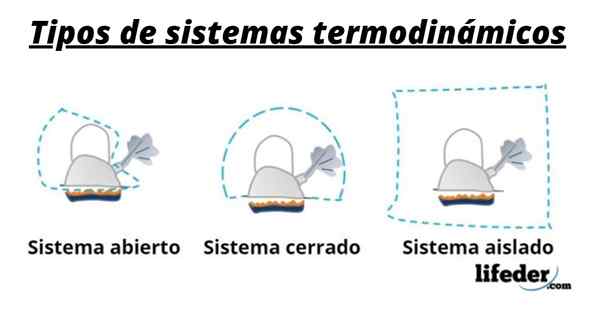
- Sistem terbuka adalah sistem yang memungkinkan transfer materi dan energi (panas) dengan lingkungannya.
- Dalam sistem tertutup ada pertukaran energi tetapi bukan masalah.
- Dalam sistem yang terisolasi transfer materi atau energi dalam bentuk panas tidak disajikan. Sistem ini juga dikenal sebagai "adiabatik".
Hukum Termokimia
 Germain Hess, Pencipta Hukum Hess, Fundamental to Thermochemistry
Germain Hess, Pencipta Hukum Hess, Fundamental to Thermochemistry Hukum termokimia terkait erat dengan hukum Laplace dan Lavoisier, serta hukum Hess, yang merupakan prekursor dari hukum termodinamika pertama.
Prinsip yang ditetapkan oleh Antoine Lavoisier Prancis (kimia penting dan mulia) dan Pierre-Simon Laplace (ahli matematika terkenal, fisik dan astronom) mengulas bahwa “Perubahan energi yang dimanifestasikan dalam transformasi fisik atau kimia memiliki hal yang sama dan bermakna Besarnya bertentangan dengan perubahan energi reaksi terbalik ".
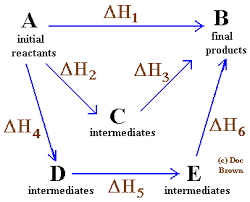
Hess Law
 Diagram Sederhana dan Umum Di mana Hukum Hess untuk Empat Reaksi Kimia diterapkan
Diagram Sederhana dan Umum Di mana Hukum Hess untuk Empat Reaksi Kimia diterapkan Dalam urutan ide yang sama, undang -undang yang dirumuskan oleh ahli kimia Rusia dari Swiss, Germain Hess, adalah landasan untuk penjelasan termokimia.
Prinsip ini didasarkan pada interpretasinya tentang hukum konservasi energi, yang mengacu pada fakta bahwa energi tidak dapat diciptakan atau dihancurkan, hanya diubah.
Hukum Hess dapat diumumkan dengan cara ini: "Total entalpi dalam reaksi kimia adalah sama, apakah reaksi dilakukan dalam satu langkah seolah -olah terjadi dalam urutan beberapa langkah".
Entalpi total terjadi sebagai pengurangan antara jumlah entalpi produk kecuali jumlah entalpi reaktan.
Dalam kasus perubahan entalpi standar suatu sistem (dalam kondisi standar 25 ° C dan 1 atm), dapat ditsperekam sesuai dengan reaksi berikut:
Dapat melayani Anda: asam klorogenikΔHreaksi = Σδh(Produk) - Σδh(Reaktan)
Cara lain untuk menjelaskan prinsip ini, mengetahui bahwa perubahan entalpi mengacu pada perubahan panas dalam reaksi ketika mereka diberikan pada tekanan yang konstan, adalah mengatakan bahwa perubahan entalpi bersih suatu sistem tidak bergantung pada jalur yang bahwa bahwa bahwa bahwa perubahan yang bergantung pada jalur yang merupakan jalur yang di jalur yang membuat jalur yang membuat jalur yang membuat jalur yang membuat jalur yang membuat jalur yang membuat jalur yang membuat jalur yang bahwa bahwa bahwa bahwa perubahan yang bergantung pada jalur yang di jalur yang bahwa bahwa bahwa bahwa perubahan yang bergantung pada jalur yang di jalur yang di jalur yang membuat jalur yang membuat jalur yang membuat jalur yang membuat jalur yang membuat jalur yang membuat jalur yang di jalur yang membuat jalur yang di jalur yang membuat jalur yang membuat jalur yang membuat jalur yang membuat jalur yang membuat jalur yang membuat jalur yang membuat jalur yang membuat jalur yang membuat jalur yang membuat jalur yang membuat jalur yang membuat jalur yang membuat jalur yang membuat jalur yang membuat jalur yang membuat jalur yang membuat jalur yang membuat jalur yang membuat jalur yang membuat jalur bahwa mengikuti antara keadaan awal dan akhir.
Hukum Termodinamika Pertama
Undang -undang ini secara intrinsik terkait dengan termokimia sehingga kadang -kadang bingung mana yang menginspirasi yang lain; Jadi, untuk memberikan lampu pada undang -undang ini, seseorang harus mulai dengan mengatakan bahwa ia juga berakar pada prinsip konservasi energi.
Sehingga termodinamika tidak hanya memperhitungkan panas sebagai bentuk transfer energi (seperti termokimia), tetapi juga melibatkan bentuk energi lainnya, seperti energi internal (ATAU).
Jadi variasi dalam energi internal suatu sistem (ΔU) diberikan oleh perbedaan antara keadaan awal dan akhir (seperti yang terlihat dalam hukum Hess).
Mempertimbangkan bahwa energi internal terdiri dari energi kinetik (pergerakan partikel) dan energi potensial (interaksi antara partikel) dari sistem yang sama, dapat disimpulkan bahwa ada faktor -faktor lain yang berkontribusi pada studi keadaan dan sifat masing -masing sistem.
Aplikasi Termokimia
Thermochemistry memiliki banyak aplikasi, beberapa di antaranya akan disebutkan di bawah ini:
- Penentuan perubahan energi dalam reaksi tertentu melalui penggunaan kalorimetri (pengukuran perubahan panas dalam sistem terisolasi tertentu).
- Pengurangan perubahan entalpi dalam suatu sistem, bahkan jika mereka tidak dapat diketahui dengan pengukuran langsung.
- Analisis transfer panas yang diproduksi secara eksperimental ketika senyawa organetalik dengan logam transisi terbentuk.
- Studi transformasi energi (panas) yang diberikan dalam senyawa koordinasi poliamina dengan logam.
- Penentuan entalpi dari tautan logam-oksigen β-DIC dan β-DICS disatukan dengan logam.
- Serta dalam aplikasi sebelumnya, termokimia dapat digunakan untuk menentukan sejumlah besar parameter yang terkait dengan jenis energi atau fungsi negara lainnya, yang merupakan yang menentukan status sistem pada waktu tertentu.
- Thermochemistry juga digunakan dalam studi berbagai sifat senyawa, seperti dalam kalorimetri titrasi.
Referensi
- Wikipedia. (S.F.). Kimia panas. Diterima dari.Wikipedia.org
- Chang, R. (2007). Kimia, Edisi Kesembilan. Meksiko: McGraw-Hill.
- Librettexts. (S.F.). Thermochemistry - Tinjauan. Diperoleh dari kimia.Librettexts.org
- Tyagi, hlm. (2006). Kimia panas. Pulih dari buku.Google.bersama.pergi
- Ribeiro, m. KE. (2012). Thermochemistry dan penerapannya pada sistem kimia dan biokimia. Diperoleh dari buku.Google.bersama.pergi
- Singh, n. B., Das, s. S., Dan Singh,. K. (2009). Kimia Fisik, Volume 2. Pulih dari buku.Google.bersama.pergi

