Pewarnaan gram
- 2884
- 768
- Pete Lesch
 Pewarnaan gram berguna untuk memvisualisasikan berbagai jenis bakteri
Pewarnaan gram berguna untuk memvisualisasikan berbagai jenis bakteri Apa pewarnaan gram?
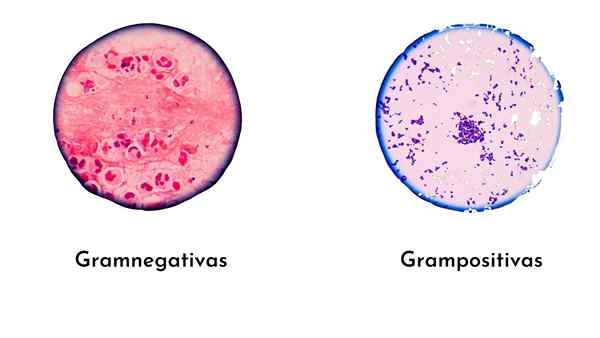
Itu Pewarnaan gram Ini adalah teknik warna paling sederhana dan paling berguna dalam mikrobiologi diagnostik untuk mengidentifikasi bakteri. Teknik ini diciptakan oleh Dokter Denmark Christian Gram pada tahun 1884, yang mengklasifikasikan bakteri dalam gram -positif (ungu) dan gram -negatif (merah muda), menurut komposisi dinding sel sel.
Teknik ini menderita modifikasi tertentu oleh Hucker pada tahun 1921 untuk menstabilkan reagen dan meningkatkan kualitas pewarnaan, sehingga pewarnaan Gram juga dikenal sebagai Gram-Hucker.
Dengan teknik ini juga mungkin. Serta distribusinya dalam ruang: dalam cluster, dalam rantai, terisolasi, berpasangan, dalam tetrad, dll.
Dasar
Ini adalah teknik yang menyajikan 4 langkah mendasar: pewarnaan, diperbaiki dengan mordan, perubahan warna dan perekrutan. Oleh karena itu, selain bakteri mewarnai, itu juga memungkinkan Anda untuk membedakannya.
Kristal violet adalah pewarna pertama yang digunakan. Hal yang sama memiliki afinitas terhadap peptidoglikan dan akan mewarnai semua bakteri yang ada, kemudian menempatkan lugol, yang bertindak sebagai mordan, yaitu, akan menginduksi pembentukan kompleks yang tidak larut dari protein kaca ungu/yodium/ribonuklear di dalam sel.
Bakteri gram -positif, memiliki dinding peptidoglikan yang tebal, membentuk lebih kompleks (gelas ungu/yodium), oleh karena itu, mereka akan diwarnai ungu.
Ini juga memengaruhi bahwa dinding bakteri gram -positif mengandung lebih banyak asam tanpa pemadaman, yang menunjukkan afinitas besar untuk agen pengoksidasi (lugol).
Bakteri gram -negatif memiliki jubah tipis peptidoglikan, yang membuat bakteri terbentuk lebih sedikit kompleks daripada gram -positif.
Selanjutnya datang langkah perubahan warna, di mana bakteri gram -positif dan gram -negatif berperilaku berbeda.
Bakteri gram -negatif mengandung membran luar yang kaya akan lipopolysaccharides yang merupakan bagian dari dinding selnya. Lemak dihancurkan oleh kontak dengan alkohol aseton, sehingga membran eksternal tidak stabil, kaca ungu dilepaskan.
Beginilah cara ini dipekerjakan dengan safranin dasar atau fuchsin, mengambil warna merah.
Dalam kasus bakteri gram -positif, mereka menahan perubahan warna karena pemutih bertindak dengan menutup pori -pori, yang mencegah kompleks kristal ungu/yodium dari bisa keluar.
Oleh karena itu, pewarnaan dengan kaca ungu stabil, dan tidak ada tempat untuk safranin atau fuchsin. Oleh karena itu, bakteri ini dicelup intens atau ungu.
Bahan
Set pewarnaan Gram terdiri dari:
- Kaca ungu.
- Lugol.
- Alkohol aseton.
- Safranin dasar atau fuchsin.
Persiapan pewarna dan reagen
Solusi kristal violet
Solusi untuk:
Crystal Violet - 2 gr
95% - 20 cc etil alkohol
Solusi B:
Ammonium oksalat - 0.8 gr
Air suling- 80 cc
Untuk persiapan akhir kaca ungu, solusi untuk 1:10 harus diencerkan dengan air suling dan aduk dengan 4 bagian larutan b. Campuran disimpan selama 24 jam sebelum menggunakannya. Itu disaring ke dalam botol pewarnaan kuning menggunakan filter kertas.
Ini dapat melayani Anda: Chiapas Flora dan Fauna: Spesies PerwakilanJumlah yang digunakan setiap hari dipindahkan ke botol kuning dengan penetes.
Yodium-lugol
Menimbang dan mengukur jumlah yang ditunjukkan dari masing -masing senyawa, sebagai berikut:
Kristal yodium - 1 gr
Kalium ioduro - 2 gr
Air suling - 300 cc
Kalium iodida dilarutkan sedikit demi sedikit di dalam air dan selanjutnya yodium ditambahkan. Solusi untuk botol kuning ditransfer.
Jumlah yang digunakan setiap hari dipindahkan ke botol kuning yang lebih kecil dengan penetes.
Disconsor
95% etil alkohol - 50 ml
Aseton - 50 ml
Itu disiapkan di bagian yang sama. Menutupi dengan baik, karena cenderung menguap.
Bottero di fut.
Persiapan ini memberikan perubahan warna waktu moderat 5-10 detik., Dan itu yang paling disarankan.
Beginters lebih suka menggunakan hanya 95%etil alkohol, di mana perubahan warna lebih lambat, dari 10 hingga 30 detik.
Sedangkan yang paling berpengalaman dapat menggunakan aseton murni, di mana perubahan warna terjadi dengan sangat cepat dari 1 hingga 5 detik.
Kontras
Solusi Ibu Safranin
Safranine - 2.5 gr
95%etil alkohol - 100 cc
Setelah menimbang jumlah safranin yang ditunjukkan, ia larut pada 100 cc etil alkohol pada 95%.
Dari solusi ibu, solusi safranin kerja disiapkan.
Untuk melakukan ini, ukur 10 cc larutan ibu, tambahkan 90 cc air suling untuk menyelesaikan 100 mL.
Disarankan untuk mentransfer jumlah yang digunakan setiap hari ke botol kuning dengan dripper.
Mikroorganisme yang dicelup dengan pewarnaan Gram-Hucker, sebagai anaerob tertentu, Legionella SP, Campylobacter SP Dan Brucella sp, Mereka dapat diwarnai jauh lebih baik jika modifikasi yang dibuat oleh Kopeloff ke pewarnaan gram-hucker, yang disebut pewarnaan gram-kopeloff dibuat.
Teknik ini mengubah pewarna safranin untuk fuchsin dasar. Dengan modifikasi ini, dimungkinkan untuk secara efektif mewarnai mikroorganisme yang disebutkan di atas.
Penyimpanan reagen
Pewarna yang disiapkan harus disimpan pada suhu kamar.
Persiapan sampel yang diperluas ke pewarnaan
Sampel harus mengandung setidaknya 105 mikroorganisme sebelum pengamatannya kemungkinan besar. Yang diperpanjang dapat dilakukan dari sampel langsung atau tanaman dalam media padat atau cair.
Yang diperpanjang harus seragam, terdistribusi dengan baik dan tidak terlalu tebal, untuk visualisasi yang lebih baik dari struktur yang ada.
Gram sampel langsung
Gram urin tanpa sentrifugasi
Urin dicampur dan 10 μl ditempatkan pada slide. Pengamatan setidaknya satu bidang bakteri/perendaman menunjukkan bahwa ada infeksi.
Ini berarti bahwa tanaman akan memiliki lebih dari 100.000 UFC/ML (105 UFC/mL) urin dalam 85% kasus.
Metode ini tidak berguna untuk jumlah kolonial di bawah 100.000 UFC.
Gram CSF
CSF harus disentrifuge, supernatan dihilangkan dan sedimen memanjang dalam slide. Cairan ini steril dalam kondisi normal. Pengamatan bakteri menunjukkan infeksi.
Dapat melayani Anda: kelenjar garamGram sampel pernapasan
Pencucian sputum gram, bronkial atau broncoalveolar, meskipun mungkin ada berbagai mikroorganisme, itu akan selalu memandu diagnosis, selain berguna jenis sel yang diamati.
Dalam kasus Esputo, yang diperluas dengan bagian sampel yang paling purulen harus disiapkan.
Tinja gram
Tidak disarankan untuk membuat gram untuk jenis sampel ini, karena tidak memiliki nilai diagnostik.
Gram tanaman
Mereka dapat dilakukan dengan dua cara, satu dari tanaman cair dan satu lagi dari tanaman padat.
Tanaman cair
Dari tanaman cair sangat sederhana: di bawah lebih ringan, beberapa daging kicauan keruh diambil dan ditempatkan pada slide yang bersih dan kering, memberikan gerakan melingkar dari pusat ke pinggiran, untuk mendistribusikan bahan secara merata.
Diizinkan secara spontan mengudara. Setelah kering, bahan dipasang pada lembaran dengan panas. Untuk melakukan ini, dengan bantuan penjepit Anda melewati lembaran 3 hingga 4 kali melalui nyala api Bunsen yang lebih ringan, berhati -hati untuk tidak membakar material.
Lembaran dibiarkan dingin dan ditempatkan di jembatan pewarnaan.
Tanaman padat
Untuk melakukan pewarnaan gram yang diperpanjang dari tanaman padat, lanjutkan sebagai berikut:
Sebelum memilih koloni untuk diambil, Anda harus menyiapkan domba slot, menempatkan sekitar dua tetes saline fisiologis steril.
Jika pelat budidaya asli berisi beberapa jenis koloni yang berbeda, koloni yang terisolasi dari masing -masing akan dipilih untuk melakukan gram. Setiap koloni akan diambil dengan pegangan platinum untuk melarutkannya dalam larutan saline yang sebelumnya ditempatkan pada slide.
Gerakan melingkar diberikan dari pusat ke pinggiran, untuk secara homogen mendistribusikan koloni di slide.
Diizinkan secara spontan mengudara. Setelah kering, lembaran dipasang dengan panas, seperti yang dijelaskan di atas (menyalakan slot slot dengan yang lebih ringan), berhati -hati untuk tidak membakar material.
Prosedur ini harus dilakukan dengan setiap jenis koloni yang berbeda. Urutan apa yang diamati, misalnya:
Colonia 1: Betahemolytic Kuning Colonia: Gram -Positif Kelapa diamati dalam kelompok.
Colonia 2: Cream Colonia, tanpa hemolisis: cocobacilli gramnegatif diamati.
Setiap lembar harus diberi label untuk mengetahui apa yang kami amati.
Teknik
Teknik warna gram sangat sederhana untuk dilakukan dan relatif ekonomis, dan tidak dapat hilang di laboratorium mikrobiologi.
Itu dilakukan sebagai berikut:
- Atur noda dengan panas dan letakkan di jembatan pewarnaan.
- Lembarannya benar -benar ditutupi dengan kaca ungu dengan 1 menit.
- Cuci dengan air. Jangan mengering.
- Tutupi lembar dengan solusi lugol, biarkan bertindak selama 1 menit. Cuci dengan air. Jangan mengering.
- Menghias 5-10 detik dengan agitasi lunak dalam alkohol aseton. O Tempatkan lembaran secara vertikal dan jatuhkan tetesan dekolorasi di permukaan sampai menyeret cadangan kristal violet. Tidak melebihi.
- Cuci dengan air. Jangan mengering.
- Tempatkan lembaran di jembatan pewarnaan dan tutupi 30 detik dengan safranine (gram-hucker) atau 1 menit dengan fuchsina dasar (gram-kopeloff).
- Cuci dengan air.
- Lepaskan secara spontan di udara dalam posisi vertikal.
Setelah kering, tempatkan 1 tetes minyak perendaman untuk mengamatinya di bawah target 100x dalam mikroskop optik.
Penggunaan/Aplikasi Pewarnaan Gram
- Teknik ini memungkinkan untuk membedakan perbedaan morfotintorial dari sebagian besar bakteri.
- Ragi juga dibedakan dengan warna ini. Mereka mengambil gelas ungu, yaitu, mereka dicat positif -positif.
- Anda dapat membedakan basil spora gram -positif, di mana ruang yang jelas diamati di dalam basil di mana endospora terbentuk, meskipun spora tidak ternoda dengan baik. Untuk mewarnai spora teknik lain digunakan, seperti shaeffer-fulton.
- Membantu menentukan jenis antibiotik yang harus disiapkan.
Perlu dicatat bahwa pewarnaan ini Tidak bekerja Untuk mewarnai semua jenis bakteri, yaitu, ada kasus di mana pewarnaan tidak berhasil.
Dalam kasus ini, bakteri yang kekurangan dinding sel dapat disebutkan. Misalnya: jenis kelamin Mycoplasma, Spheroplast, UreAcplasma, L bentuk dan protoplas.
Selain itu, bakteri dengan bakteri yang kaya akan asam mikolik, seperti mikobakteri, dan bakteri intraseluler, seperti klamidia dan rickettsias.
Ini juga tidak efektif untuk mewarnai sebagian besar bakteri spirochemal.
Ada bakteri dari genus yang sama yang dapat diamati dalam sampel yang sama dengan gram -positif dan sebagai gram -negatif. Ketika ini terjadi, itu disebut pewarnaan gram variabel, yang mungkin disebabkan oleh perubahan nutrisi, suhu, pH atau konsentrasi elektrolit.
Kesalahan Umum
Hiasi secara berlebihan
Lebih berlebihan dalam Pass Discoloration dapat menyebabkan pengamatan mikroorganisme gram palsu palsu.
Jangan menunggu waktu pengeringan yang cukup untuk menambahkan oli perendaman
Kesalahan ini menyebabkan mikel lemak membentuk yang menghambat pengamatan struktur yang ada. Ini terjadi ketika minyak bergabung dengan molekul air yang ada dalam bau.
Investasikan urutan reagen
Kesalahan seperti ini akan menghasilkan bakteri gram -negatif untuk divisualisasikan, yaitu, gram palsu -positif.
Gunakan tanaman lama (padatan atau cairan)
Itu dapat menyebabkan bakteri gram -positif menodai gram -negatif (gram -negative false). Ini terjadi karena pada tanaman lama ada kemungkinan bahwa ada bakteri mati atau memburuk, dan dalam kondisi ini bakteri tidak mempertahankan kaca ungu.
Gunakan solusi lugol yang sangat tua
Seiring waktu, Lugol kehilangan propertinya dan warnanya memudar. Jika reagen yang sudah didegenerasi digunakan, ini tidak akan memperbaiki kaca ungu dengan baik, oleh karena itu ada kemungkinan mendapatkan visualisasi mikroorganisme gram -negatif yang salah.
Latar belakang biru
Latar belakang yang berubah warna yang benar akan menjadi merah. Latar belakang biru menunjukkan bahwa perubahan warna tidak cukup.
Referensi
- Rumah-Rincón, g. (1994). Mikologi Umum. Universitas Pusat Venezuela.
- Pewarnaan gram. Diambil darinya.Wikipedia.org.
- González, m., González, n. (2011). Manual Mikrobiologi Medis. Direktorat Media dan Publikasi Universitas Carabobo.

