Atom netral
- 2597
- 755
- Irvin Reichel
Apa itu atom netral?
A atom netral Ini adalah salah satu yang tidak memiliki muatan listrik karena kompensasi antara jumlah proton dan elektronnya. Keduanya adalah partikel subatomik yang dimuat secara elektrik.
Proton diaglomerasi di sebelah neutron, dan membentuk nukleus; Sementara elektron kabur dengan mendefinisikan awan elektronik. Ketika jumlah proton dalam atom, sama dengan jumlah atomnya (z), sama dengan jumlah elektron, dikatakan bahwa ada kompensasi antara muatan listrik dalam atom.
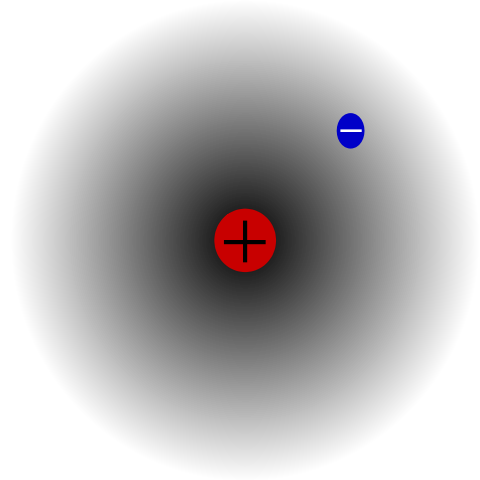
 Atom hidrogen. Sumber: Mets501 via Wikipedia.
Atom hidrogen. Sumber: Mets501 via Wikipedia. Misalnya ada atom hidrogen (gambar superior), yang memiliki proton dan elektron. Proton diposisikan di tengah atom sebagai inti, sedangkan elektron mengorbit ruang di sekitarnya, meninggalkan daerah dengan kepadatan elektronik yang lebih sedikit saat bergerak menjauh dari nukleus.
Ini adalah atom netral karena benar bahwa z sama dengan jumlah elektron (1p = 1e). Jika atom H kehilangan proton tunggal itu, jari -jari atom diangkatnya dan akan menang dengan beban proton, menjadi kation H+ (Hydron). Jika, di sisi lain, ia memenangkan elektron, akan ada dua elektron dan akan menjadi anion h-- (Hidrida).
Atom netral vs ion
Untuk contoh atom netral H, terlihat bahwa dipenuhi bahwa jumlah proton sama dengan jumlah elektron (1p = 1e); situasi yang tidak terjadi dengan ion yang berasal dari Kerugian atau gain elektron.
Ion dibentuk oleh perubahan jumlah elektron, baik karena atom menang (-) atau kehilangan mereka (+).
Dapat melayani Anda: fase tersebarDi atom kation h+ Valencia proton soliter mendominasi dalam menghadapi total tidak adanya elektron (1p> 0e). Ini berlaku untuk semua atom berat lainnya (np> ne) dari tabel periodik.
Meskipun keberadaan beban positif mungkin tampak tidak signifikan, dia secara diagonal mengubah karakteristik elemen yang dimaksud.
Di sisi lain, di atom anion h- Beban negatif dari dua elektron mendominasi di depan satu -satunya proton nukleus (1p<2e). Igualmente, los demás aniones de mayor masa tienen un exceso de electrones en comparación al número de protones (np
Na vs na+
Contoh yang lebih dikenal adalah natrium logam. Atomnya yang netral, Na, dengan z = 11, memiliki 11 proton; Oleh karena itu, harus ada 11 elektron untuk mengimbangi beban positif (11p = 11e).
Sodium untuk menjadi elemen logam yang sangat elektropositif, kehilangan elektron dengan sangat mudah; Dalam hal ini, hanya kehilangan satu, lapisan Valencia (11p> 10e). Dengan demikian, kation terbentuk+, yang berinteraksi secara elektrostatik dengan anion; Seperti klorida, CL-, Dalam garam garam klorida, NaCl.
Sodium logam beracun dan korosif, sedangkan kationnya bahkan ada di dalam sel. Ini menunjukkan bagaimana sifat -sifat suatu elemen dapat bervariasi secara drastis saat menang atau kehilangan elektron.
Di sisi lain, ni na- (Soduro, secara hipotetis) tidak ada; Dan untuk dapat membentuk, itu akan sangat reaktif, karena bertentangan dengan sifat kimia natrium untuk memenangkan elektron. Na- Itu akan memiliki 12 elektron, mengatasi muatan positif nukleusnya (11p<12e).
Dapat melayani Anda: oksigen molekuler: struktur, sifat, penggunaanMolekul netral
Atom terkait secara kovalen untuk menimbulkan molekul, senyawa mana juga dapat disebut. Dalam molekul tidak ada ion yang terisolasi; Sebaliknya, ada atom dengan beban formal positif atau negatif. Atom -atom yang dimuat ini mempengaruhi beban bersih molekul, mengubahnya menjadi ion polikimik.
Agar suatu molekul menjadi netral jumlah beban formal atom -atomnya harus sama dengan nol; Atau, lebih sederhana, semua atomnya netral. Jika atom yang membentuk molekul itu netral, ini juga akan terjadi.
Misalnya, Anda memiliki molekul air, h2SALAH SATU. Dua atom H -nya netral, seperti atom oksigen. Mereka tidak dapat diwakili dengan cara yang sama seperti yang ditunjukkan pada gambar atom hidrogen; Karena, meskipun nukleus tidak berubah, awan elektronik tidak.
Ion hidroni, h3SALAH SATU+, Di sisi lain, ia memiliki atom oksigen dengan beban parsial yang positif. Ini berarti bahwa dalam ion poliiatomik itu kehilangan elektron, dan, oleh karena itu, jumlah protonnya lebih besar dari elektronnya.
Contoh atom netral
Oksigen
Atom oksigen netral memiliki 8 proton dan 8 elektron. Ketika dia memenangkan dua elektron, membentuk apa yang dikenal sebagai oksida anion, atau2-. Di dalamnya, beban negatif mendominasi, memiliki kelebihan dua elektron (8p<10e).
Atom oksigen netral memiliki kecenderungan tinggi untuk bereaksi dan bergabung dengan diri mereka sendiri untuk membentuk atau2. Karena alasan itulah tidak ada atom atau "longgar" di sana untuk nasib Anda dan tanpa bereaksi dengan apapun. Semua reaksi yang diketahui untuk gas ini diberikan kepada oksigen molekuler, atau2.
Itu dapat melayani Anda: logam alkalinoterrousTembaga
Tembaga memiliki 29 proton dan 29 elektron (selain neutron). Tidak seperti oksigen, atom netral mereka dapat ditemukan di alam karena ikatan logamnya dan stabilitas relatif.
Seperti natrium, cenderung kehilangan elektron alih -alih memenangkannya. Mengingat konfigurasi elektronik dan aspek lainnya, Anda dapat kehilangan satu atau dua elektron, menjadi cupros+, o cuprico, cu2+, masing -masing.
Cucion Cu+ Ini memiliki lebih sedikit elektron (29p<28e), y el Cu2+ telah kehilangan dua elektron (29p<27e).
gas mulia
Gas mulia (he, ne, ar, kr, xe, rn), adalah salah satu dari sedikit elemen yang ada dalam bentuk atom netral mereka. Angka atomnya adalah: 2, 10, 18, 36, 54 dan 86, masing -masing. Mereka tidak menang atau kehilangan elektron; Meskipun, xenon, xe, dapat membentuk senyawa dengan fluor dan kehilangan elektron.
Paduan logam
Logam dilindungi dari korosi dapat mempertahankan atom netral mereka, disatukan oleh tautan logam. Dalam paduan, larutan logam padat, atom tetap (kebanyakan) netral. Dalam kuningan, misalnya, ada atom netral Cu dan Zn.
Referensi
- Apa itu atom netral? Dipulihkan dari: Pendahuluan-ke-fisik.com
- Contoh atom non netral. Ilmu pengetahuan. Pulih dari: ilmuwan.com

