Struktur torio, sifat, memperoleh, menggunakan

- 3059
- 564
- Ray Thiel
Dia Torio Ini adalah elemen logam yang termasuk dalam serangkaian aktinid, dari tanah jarang yang disebut SO, dan yang simbol kimianya adalah th. Ini memiliki jumlah atom 90 dan berat atom 232 g/mol. Senyawa torio biasanya mengandungnya dengan nomor oksidasi +4 (th4+).
Senyawa torio dioksida, tho2, Dikenal secara industri sebagai Toria, dan digunakan di sebagian besar aplikasi torium, ditandai dengan menjadi senyawa kimia dengan titik leleh terbesar (3.300 ºC).
 Sampel thorium logam disimpan dalam lepuh kaca di bawah argon. Lapisan kehitamannya adalah karena oksida. Sumber: Alchemist-HP (Talk) (www.PSE-Mendelejew.de) / fal
Sampel thorium logam disimpan dalam lepuh kaca di bawah argon. Lapisan kehitamannya adalah karena oksida. Sumber: Alchemist-HP (Talk) (www.PSE-Mendelejew.de) / fal Torio ditemukan pada tahun 1828 oleh Mortar Thrane Esmark, yang ditemukan di pulau Norwegia Løvøya, mineral hitam. Esmark mengirimkan mineral ke Job Jacob Berzelius, yang menganalisisnya menemukan logam yang tidak dikenal dalam dirinya.
Dia menyebut mineral hitam sebagai Torita (Thorita) untuk menghormati dewa Skandinavia Thor. Sementara itu, logam yang tidak diketahui disebut Torio (Thorium). Karakter radioaktif thorium didirikan oleh Anton Edward Van Arkel dan Jan Hendrik de Boer, dan secara mandiri oleh Pierre Curie dan Marie Curie.
[TOC]
Sifat torium
Fisik
Thorium adalah logam putih radioaktif, cerah, cukup keras, perak, ulet dan lunak, yang kabut sangat lambat di udara, berubah menjadi abu -abu dan kemudian hitam. Itu milik kelompok aktinid, mengidentifikasi dengan nomor atom 90 dan berat atom 232 g/mol.
Radioaktivitas
Torio-232 (232Th90) merupakan lebih dari 99% dari total elemen thorium yang ada di korteks bumi. Dapat dipertimbangkan bahwa itu adalah isotop yang stabil, meskipun radioaktif, karena setengah -kehidupannya adalah 1.405 x 1010 bertahun-tahun. Secara radioaktif menurun dengan emisi partikel α dan β, dan radiasi γ.
Torio-232 diubah menjadi radio-268 (268Ra88) dengan mengeluarkan partikel alfa, dibentuk oleh dua proton dan dua neutron. Thorium dapat menderita serangkaian disintegrasi radioaktif sampai menjadi elemen yang stabil: timah-208.
Dapat melayani Anda: timah klorida: sifat, struktur, penggunaanTorio-232 mampu menangkap neutron untuk berubah menjadi elemen radioaktif uranium-233, memancarkan radiasi tipe β β. Uranium, di sisi lain, digunakan dalam reaktor nuklir untuk produksi energi.
Reaktivitas
Thorium adalah logam elektropositif dan sangat reaktif. Itu teroksidasi sangat lambat di udara, meskipun korosi dapat terjadi setelah beberapa bulan. Saat dipanaskan di udara, dihidupkan, memancarkan cahaya putih terang sementara produksi torio dioksida, tho2.
Di bawah kondisi suhu dan tekanan standar, thorium perlahan diserang oleh air. Demikian juga, thorium tidak dilarutkan dalam sebagian besar asam umum, dengan pengecualian asam klorida, di mana ia larut meninggalkan residu hitam yang tidak larut.
Ini juga dilarutkan dalam asam nitrat pekat dengan sejumlah kecil katalitik atau fluorosilik fluorida. Thorium adalah logam piroforis: saat menjadi bubuk itu mampu menyala secara spontan.
Struktur
Atom Torio membentuk kristal struktur kubik yang berpusat pada wajah (FCC) pada suhu kamar. Ketika dipanaskan di atas 1360 ºC, kaca mengalami transisi ke fase kubik yang berpusat pada tubuh (BCC), dari kepadatan yang lebih rendah. Sementara itu, thorium di bawah tekanan tinggi (100 GPa atau lebih), memperoleh struktur tetragonal padat yang berpusat pada tubuh (BCT).
Konfigurasi elektronik
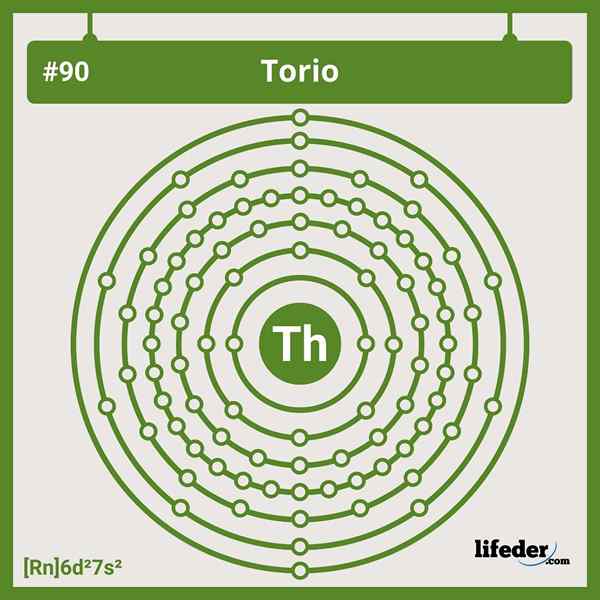 Pengaturan Torium Elektronik
Pengaturan Torium Elektronik Konfigurasi elektronik yang disingkat untuk thorium adalah sebagai berikut:
[Rn] 6d2 7S2
Kehilangan empat elektron Valencia berubah menjadi kation4+. Perhatikan bahwa meskipun berakting, ia tidak memiliki elektron dalam orbital 5F, berbeda dengan aktinid lainnya.
Dapat melayani Anda: fase dispersingMemperoleh
Mineral utama yang digunakan untuk mendapatkan thorium adalah monakit. Langkah awal adalah pemisahannya dari deposit utamanya: Pegmatita. Logam alkalinotherrous karbonat dihilangkan dari pegmatit dengan reaksi fragmennya dengan hidrogen klorida.
Fragmen yang dihasilkan dikalsinasi dan disaring, kemudian menjalani pemisahan magnetik. Dengan demikian bahan monakita berpasir diperoleh. Pasir ini mengalami pencernaan asam sulfat 93%, pada suhu 210 hingga 230 ° C, dan selama beberapa jam. Larutan asam yang terbentuk kemudian diencerkan dengan air sepuluh kali volumenya.
Monakita tetap tenggelam ke bawah, sedangkan thorium dan unsur -unsur lain dari tanah jarang melayang dalam persiapan asam. PH ke 1 disesuaikan.3, yang menghasilkan presipitasi thorium sebagai fosfat, sedangkan sisa lahan langka dalam suspensi tetap dalam larutan.
Saat ini pemisahan dan pemurnian dilakukan dengan menggunakan pelarut cair, misalnya, upeti fosfat di queroseno.
Torio Metal dapat terjadi dalam jumlah komersial dengan pengurangan metalotermal di Totrafluoruro de Torio (THF4) dan torio dioksida (tho2), atau dengan elektrolisis thorium tetrachloride (THCL4).
Aplikasi
Thorium telah memiliki banyak aplikasi, banyak di antaranya telah dibuang sejak tahun 1950 -an, karena karakter radioaktifnya merupakan risiko kesehatan.
Industrialis
Paduan
Thorium telah paduan dengan tungsten sebagai elektroda dalam pengelasan TIG (gas inert tungsten), yang merupakan 2% dari paduan.
Dalam jumlah kecil Torio telah ditambahkan ke filamen tungsten untuk mengurangi kristalisasi, sehingga memungkinkan emisi elektron untuk menurunkan suhu. Kabel tungsten-torio telah digunakan dalam tabung elektronik dan dalam elektroda tabung sinar-X dan penyearah.
Torio dioksida telah digunakan dalam pengelasan busur tungsten, karena resistensi tungsten terhadap suhu elektroda logam yang tinggi meningkat. Namun, itu telah diganti dalam aplikasi ini oleh Sircirherisher, Cerio atau Lantano Oxides.
Dapat melayani Anda: dari mana datangnya plastik? Sejarah dan JenisPetir
Totrafluoruro de Torio, di sisi lain, telah digunakan sebagai bahan untuk mengurangi refleks dalam pelapis optik multicapa, yang transparan menjadi terang dengan panjang gelombang antara 0.350 hingga 1.2 μm. Namun, Torio Salt telah diganti dalam penggunaan ini oleh Tetrafluoruro de Lantano.
Torio dioksida telah digunakan dalam pencahayaan cahaya, untuk memancarkan cahaya cemerlang yang sesuai dengan cahaya yang terlihat. Meskipun thorium masih digunakan dalam aplikasi ini, sebagian telah digantikan oleh ITE.
Bahan refraktori
Thorium juga telah digunakan dalam elaborasi bahan refraktori untuk industri metalurgi dan dalam krisol keramik untuk laboratorium pengajaran dan penelitian.
Reaktor nuklir
Torio-232 digunakan dalam reaktor nuklir untuk menangkap neutron gerak lambat, karena hal itu diubah menjadi uranium-233. Elemen radioaktif ini secara fisik dan digunakan untuk produksi energi.
Pengembangan reaktor nuklir berdasarkan TORIO-32 telah lambat, menciptakan reaktor pertama dengan karakteristik ini di Pusat Energi Point India, yang terletak di Buchanan USA, pada tahun 1962. Torio-232 Reaktor nuklir tidak memancarkan plutonium, yang membuat mereka lebih sedikit polutan.
Referensi
- Shiver & Atkins. (2008). Kimia anorganik. (edisi keempat). MC Graw Hill.
- Wikipedia. (2020). Thorium. Diperoleh dari: di.Wikipedia.org
- Pusat Nasional Informasi Bioteknologi (2020). Thorium. Ringkasan Pubchem Comunund untuk CID 23974. Pulih dari: pubchem.NCBI.Nlm.Nih.Pemerintah
- Kata. Doug Stewart. (2020). Fakta Elemen Thorium. Pulih dari: chemicool.com
- Para editor Eeritlopaedia Britannica. (2020). Thorium. Dipulihkan dari: Britannica.com
- Lentech b.V. (2020). Thorium. Pulih dari: lentech.com
- Rachel Ross. (1 Maret 2017). Fakta tentang Thorium. Dipulihkan dari: LiveScience.com
- Advameg. (2020). Thorium. Pulih dari: chemistry explaed.com

