Karakteristik troponin, struktur, fungsi dan tes
- 3687
- 27
- Jessie Harvey
Troponin Ini adalah nama yang menerima protein yang ada di otot kerangka dan jantung vertebrata, yang terkait dengan filamen dalam serat otot dan yang memiliki fungsi dalam regulasi aktivitas kontraktil (kontraksi dan relaksasi otot).
Serat otot adalah sel yang membentuk jaringan otot, yang kapasitas kontraknya didasarkan pada interaksi antara filamen yang dipesan dan terkait erat di dalamnya, menempati sebagian besar volume sitoplasma.
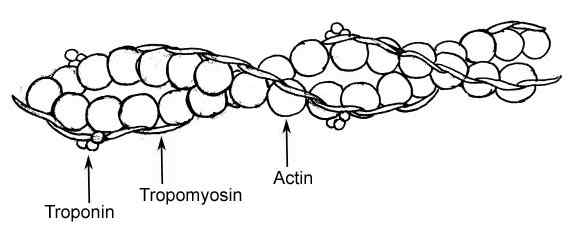 Representasi grafis dari unsur -unsur filamen tipis dalam serat otot (sumber: raul654, melalui Wikimedia Commons)
Representasi grafis dari unsur -unsur filamen tipis dalam serat otot (sumber: raul654, melalui Wikimedia Commons) Filamen ini dikenal sebagai miofilamen dan ada dua kelas: ketebalan dan tipis. Filamen tebal terdiri dari molekul myosin II, sedangkan filamen tipis adalah aktin globular atau polimer aktin g dalam hubungannya dengan dua protein lainnya.
Baik aktin dan myosin juga ditemukan dalam sel -sel lain dari tubuh manusia dan organisme lainnya, hanya dalam proporsi yang jauh lebih sedikit dan berpartisipasi dalam proses yang berbeda seperti migrasi sel, eksositosis, pada sitosinesis (selama pembelahan sel) dan bahkan dalam lalu lintas vesikuler intraseluler intraseluler intraseluler (.
Troponin dan tropomiosin adalah dua protein yang terkait dengan filamen aktin tipis yang berpartisipasi dalam regulasi proses kontraksi dan relaksasi myofibril sel otot atau serat.
Mekanisme aksi yang melaluinya kedua protein ini menjalankan fungsinya terkait dengan konsentrasi kalsium intraseluler. Sistem regulasi troponin adalah salah satu sistem yang paling terkenal dalam fisiologi dan biokimia kontraksi otot rangka.
Protein ini sangat penting bagi tubuh. Saat ini diketahui pasti bahwa beberapa kardiomiopati keluarga atau bawaan adalah produk dari mutasi dalam urutan gen yang mereka kodekan untuk baik (troponin atau tropomiosin).
[TOC]
Karakteristik
Troponin dikaitkan dengan aktin filamen tipis serat otot pada otot kerangka dan jantung dalam rasio stoikiometrik 1 hingga 7, yaitu molekul troponin untuk setiap 7 molekul aktin.
Protein ini, seperti yang ditekankan, ditemukan secara eksklusif dalam filamen yang terkandung di dalam myofibril serat otot kerangka dan lurik jantung, dan bukan pada serat otot polos yang membentuk otot vaskular dan visceral.
Ini dipahami oleh beberapa penulis seperti protein pengatur tropomiosin. Seperti ini, ia memiliki situs serikat untuk interaksi dengan molekul aktin, yang memberikan kemampuan untuk mengatur interaksinya dengan myosin filamen tebal.
Dapat melayani Anda: Aldohexosa: Struktur dan contoh molekulDalam miofilamen, hubungan antara molekul troponin dan tropomiosin adalah 1 banding 1, yang berarti bahwa untuk setiap kompleks troponin yang ada ada molekul tropomiosin yang terkait dengan ini.
Struktur
Troponin adalah kompleks protein yang terdiri dari tiga subunit globular berbeda yang dikenal sebagai troponin I, troponin C dan troponin T, yang bersama -sama menambahkan, lebih atau kurang, 78 kDa.
Dalam tubuh manusia ada varian spesifik jaringan untuk masing-masing subunit ini, yang berbeda satu sama lain pada tingkat genetik dan molekul (sehubungan dengan gen yang mengkode mereka), seperti pada tingkat struktural (sehubungan dengan asam amino mereka Urutan).
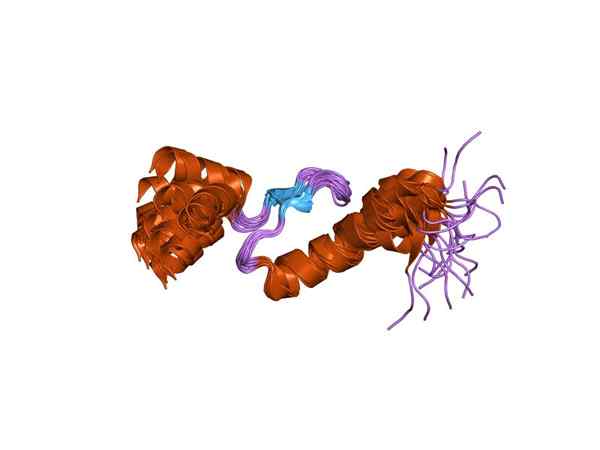
 Representasi salah satu subunit troponin (Sumber: Jawahar Swaminathan dan Staf MSD di European Bioinformatics Institute [domain publik] melalui Wikimedia Commons)
Representasi salah satu subunit troponin (Sumber: Jawahar Swaminathan dan Staf MSD di European Bioinformatics Institute [domain publik] melalui Wikimedia Commons) Toponin C atau TNC adalah yang terkecil dari tiga subunit dan mungkin salah satu yang paling penting. Ini memiliki berat molekul 18 kDa dan memiliki situs untuk bergabung dengan kalsium (Ca2+).
TNT troponin adalah yang memiliki situs serikat untuk melabuhkan kompleks dari tiga subunit untuk tropomiosin dan memiliki berat molekul 30 kDa; Ini juga dikenal sebagai persimpangan T -subunit atau tropomiosine.
Troponin I atau TNI, dari lebih dari 180 limbah asam amino, memiliki berat molekul yang sama dengan troponin T, tetapi dalam strukturnya memiliki situs khusus untuk bergabung dengan aktin, menghalangi interaksi antara yang terakhir dan myosin, yang merupakan fenomena yang bertanggung jawab untuk kontraksi serat otot.
Banyak buku teks merujuk pada subunit ini seperti subunit penghambat dan sebagai "pasta" molekuler antara tiga subunit troponin. Kemampuannya untuk menyatu untuk bertindak dan aktivitas penghambatannya ditingkatkan dengan hubungannya dengan tropomiosin, dimediasi oleh subunit TNT.
Telah ditunjukkan bahwa, dalam subunit I, wilayah urutan yang bertanggung jawab atas penghambatan ditentukan oleh peptida sentral dari 12 limbah asam amino antara posisi 104 dan 115; dan bahwa wilayah C-terminal subunit juga memiliki fungsi selama penghambatan.
Fungsi
Fungsi utama troponin dalam kontraksi otot tergantung pada kemampuannya untuk bergabung dengan kalsium, karena protein ini adalah satu -satunya komponen filamen tipis pada otot lurik yang dimiliki properti ini.
Dengan tidak adanya troponin, filamen tipis mampu bergabung dengan filamen tebal dan kontrak, terlepas dari konsentrasi kalsium intraseluler, sehingga fungsi troponin adalah untuk menghindari kontraksi tanpa adanya kalsium melalui hubungannya dengan tropomiosin.
Dapat melayani Anda: ovuliparosDengan demikian, troponin memainkan peran penting dalam pemeliharaan relaksasi otot ketika tidak ada cukup kalsium intraseluler, dan dalam kontraksi otot ketika stimulus listrik saraf memungkinkan masuknya kalsium ke dalam serat otot.
Bagaimana ini terjadi?
Pada otot kerangka dan lurik jantung, kontraksi otot terjadi berkat interaksi antara filamen tipis dan tebal yang saling meluncur.
Dalam sel-sel otot-otot ini, kalsium sangat penting untuk interaksi akting-mulosin (filamen tipis dan tebal), karena situs serikat aktin untuk myosin "disembunyikan" dengan aksi bersama tropomiosin dan troponin, yang meresponsnya ke kalsium.
Ion kalsium yang berasal dari retikulum sarkoplasma (retikulum endoplasma dari serat otot) mengikat subunit c troponin, yang menetralkan penghambatan yang dimediasi oleh troponin dan kontraksi otot dipicu dipicu dipicu dipicu dipicu dipicu dipicu dipicu dipicu dipicu dipicu dipicu dipicu dipicu dipicu dipicu dipicu dipicu dipicu dipicu dipicu dipicu dipicu dipicu dipicu dipicu dipicu dipicu dipicu dipicu dipicu dipicu dipicu dipicu dipicu dipicu dipicu dipicu dipicu dipicu dipicu dipicu dipicu dipicu dipicu dipicu dipicu dipicu dipicu dipicu dipicu dipicu dipicu dipicu dipicu dipicu dipicu dipicu dipicu dipicu dipicu dipicu dipicu.
"Netralisasi" dari penghambatan yang disebabkan oleh subunit I terjadi setelah penyatuan kalsium ke subunit C, yang menghasilkan perubahan konformasi yang menyebar antara ketiga subunit dan memungkinkan disosiasi molekul aktin dan tropomiosin.
Disosiasi antara troponin, tropomiosin dan aktin ini mengekspos dalam aktin situs serikat untuk myosin. Maka kepala globular yang terakhir dapat berinteraksi dengan serat aktin dan memulai kontraksi yang bergantung pada ATP karena perpindahan satu filamen di atas yang lain.
Tes troponin
Troponin adalah biomarker pilihan untuk mendeteksi lesi jantung. Oleh karena itu, tes troponin banyak digunakan dalam diagnosis biokimia, dini dan/atau preventif, dari beberapa kondisi patologis jantung seperti infark miokard akut.
Banyak dokter yang merawat menganggap bahwa tes ini memfasilitasi pengambilan keputusan sehubungan dengan apa yang harus dilakukan dan pengobatan apa untuk mengelola pasien yang mengalami nyeri dada.
Secara umum, ini terkait dengan deteksi subunit T dan I dari troponin, karena troponin C isforma juga ditemukan pada otot rangka kontraksi lambat; Artinya, tidak spesifik untuk hati.
Apa yang didasarkan pada tes troponin?
Tes troponin biasanya merupakan uji kekebalan yang mendeteksi isoform jantung subunit T dan I dari troponin. Kemudian, ini didasarkan pada perbedaan yang ada antara kedua isoform.
Dapat melayani Anda: sintesis proteinIsoform subunit toponine I (ctni) (ctni)
Di jaringan otot miokardium hanya ada satu isoform dari subunit I troponin, ditandai dengan adanya "ekor" pasca-translasi dari 32 asam amino pada ujung terminalnya N-terminalnya.
Isoform ini terdeteksi berkat perkembangan antibodi monoklonal spesifik yang tidak mengenali isoform non-kardiak lainnya, karena ekor asam amino kurang atau kurang 50% berbeda dari ujung isoform lainnya.
CTNI tidak diekspresikan dalam kain yang rusak, tetapi eksklusif untuk jaringan jantung dewasa.
Isoform subunit troponin t (ctnt) (ctnt)
Isoform jantung dari subunit t troponin dikodekan dalam tiga gen yang berbeda, yang ARNM dapat mengalami pemotongan alternatif dan splices yang menghasilkan produksi isoform dengan urutan variabel pada ujung N-dan-C-terminal.
Meskipun otot jantung manusia mengandung 4 isoform TNT, hanya satu yang merupakan karakteristik dari jaringan jantung orang dewasa. Ini terdeteksi dengan antibodi spesifik yang dirancang terhadap ujung terminal-N dari urutan aminooacidalnya.
Tes "Generasi Baru" untuk subuniditas T isoform jantung sangat memperhatikan fakta bahwa beberapa jaringan kerangka yang terluka dapat mengekspresikan kembali isoform ini, sehingga reaksi silang dapat diperoleh dengan antibodi.
Referensi
- Babuin, l., & Jaffe, a. S. (2005). Troponin: Biomarker pilihan untuk mendeteksi cedera jantung. CMAJ, 173(10), 1191-1202.
- Collinson, hlm., Stubbs, hlm., & Kessler, a.-C. (2003). Evaluasi multisenter dari nilai diagnostik troponin T, massa CK-MB, dan mioglobin untuk menilai pasien dengan dugaan sindrom koroner akut dalam praktik praktik klinis rutin. Jantung, 89, 280-286.
- Farah, c., & Reinach, f. (sembilan belas sembilan puluh lima). Kompleks troponin dan regulasi kontraksi otot. Faseb, 9, 755-767.
- Keller, t., Peetz, d., Tzikas, s., Roth, a., Czyz, e., Bickel, c.,... Blankenberg, s. (2009). Sensitif Troponin I uji dalam diagnosis dini infarcation miokard akut. The New England Journal of Medicine, 361(9), 868-877.
- Ross, m., & Pawlina, w. (2006). Histologi. Teks dan atlas dengan sel berkorelasi dan biologi molekuler (Edisi ke -5.). Lippinott Williams & Wilkins.
- Wakabayashi, t. (2015). Mekanisme Pengaturan Kalsium Kontraksi Otot. Dalam mengejar basis strukturalnya. Proc. Jpn. Acade. Menjadi. B, 91, 321-350.
- « Karakteristik tropomiosin, struktur dan fungsi
- Konsep panas sensitif, formula dan latihan diselesaikan »

