Voltamperometri
- 1615
- 10
- Ernesto Mueller
 Voltamperometry adalah metode elektrokimia yang mengukur arus elektroda
Voltamperometry adalah metode elektrokimia yang mengukur arus elektroda Apa itu voltamperometry?
Itu Voltamperometri Ini adalah teknik elektroanalitik yang menentukan informasi dari spesies kimia atau analit dari arus listrik yang dihasilkan oleh variasi potensi yang diterapkan. Yaitu, potensi E (V) yang diterapkan, dan waktu (t), adalah variabel independen; Sedangkan arus (a), variabel dependen.
Spesies kimia biasanya harus elektroaktif. Ini berarti bahwa ia harus kehilangan (mengoksidasi) atau memenangkan (mengurangi) elektron. Agar reaksi memulai, elektroda kerja harus memberikan potensi yang diperlukan secara teoritis oleh persamaan Nernst.
Metode ini banyak digunakan dalam anorganik, biokimia dan kimia fisik, terutama untuk menganalisis oksidasi, pengurangan atau proses adsorpsi, antara lain.
Bagaimana voltamperometry bekerja?
Voltamperometry dikembangkan berkat penemuan Hadiah Nobel Nobel Nobel Nobel 1922, Jaroslav Heyrovsky (1890-1967). Di dalamnya, elektroda drop merkuri (EGM) terus diperbarui dan terpolarisasi.
Kekurangan analitik dari metode ini pada waktu itu diselesaikan dengan penggunaan dan desain mikroelektroda lainnya. Ini sangat bervariasi dari material, dari batubara, logam mulia, berlian dan polimer, bahkan dalam desainnya, cakram, silinder, lembaran; Dan di samping itu, dengan cara mereka berinteraksi dengan solusi: stasioner atau putar.
Semua detail ini dimaksudkan1). Ini sebanding dengan konsentrasi analit, dan setengah dari kekuatan E (E (E (E1/2) untuk mencapai setengah dari saat ini (i1/2) adalah karakteristik spesies.
Jadi, menentukan nilai e1/2 Dalam kurva di mana arus yang diperoleh dengan variasi e adalah grafik, disebut Voltamperaogram, Kehadiran analit dapat diidentifikasi. Yaitu, masing -masing analit, mengingat kondisi percobaan, akan memiliki nilai e sendiri1/2.
Dapat melayani Anda: titik kesetaraanGelombang voltamperometrik
Dalam voltamperometry kami bekerja dengan banyak grafik. Yang pertama adalah kurva E VS. t, yang memungkinkan Anda untuk memantau perbedaan potensial yang diterapkan sebagai fungsi waktu.
Tetapi pada saat yang sama, sirkuit listrik mencatat nilai -nilai C yang dihasilkan oleh analit saat kehilangan atau mendapatkan elektron di sekitar elektroda.
Karena elektroda terpolarisasi, lebih sedikit analit dapat disebarkan dari dada solusi untuk itu. Misalnya, jika elektroda memiliki muatan positif, spesies x- Dia akan tertarik pada ini dan akan membawanya hanya untuk daya tarik elektrostatik.
Tapi x- tidak sendiri: ada ion lain yang ada di lingkungan Anda. Beberapa kation m+ Mereka dapat menghalangi jalan mereka ke elektroda dengan menemukannya di "kelompok" muatan positif; Dan juga, anion n- Mereka dapat dicuri di sekitar elektroda dan mencegah x- Saya mendatanginya.
Jumlah fenomena fisik ini menyebabkan arus hilang, dan ini diamati pada C vs. E dan bentuknya mirip dengan A S, yang disebut bentuk sigmoid. Kurva ini dikenal sebagai gelombang voltamperometrik.
Peralatan
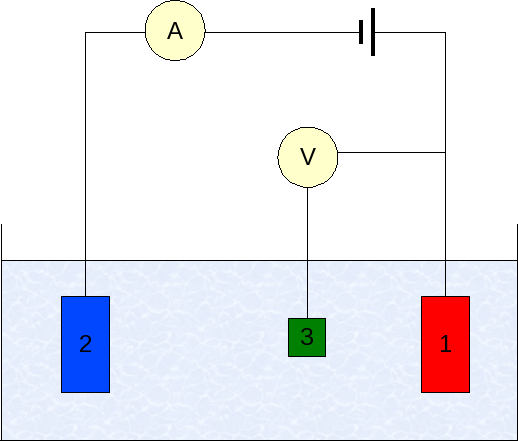 Elektroda dalam voltamperometri. Sumber: Wikimedia Commons
Elektroda dalam voltamperometri. Sumber: Wikimedia Commons Instrumentasi voltamperometri bervariasi sesuai dengan analit, pelarut, jenis elektroda dan aplikasi. Tapi, sebagian besar dari mereka didasarkan pada sistem yang terdiri dari tiga elektroda: salah satu pekerjaan (1), bantu (2) dan referensi (3).
Elektroda referensi utama yang digunakan adalah elektroda calomenanos (ECS). Ini, bersama dengan elektroda kerja, memungkinkan untuk menetapkan perbedaan potensial ΔE, karena potensial elektroda referensi tetap konstan selama pengukuran.
Dapat melayani Anda: selenium: sejarah, sifat, struktur, mendapatkan, menggunakanDi sisi lain, elektroda tambahan bertanggung jawab untuk mengendalikan beban yang diteruskan ke elektroda kerja, untuk mempertahankannya dalam nilai yang dapat diterima. Variabel independen, perbedaan potensial yang diterapkan, adalah yang diperoleh dengan jumlah potensi elektroda kerja dan referensi.
Jenis Voltamperometri
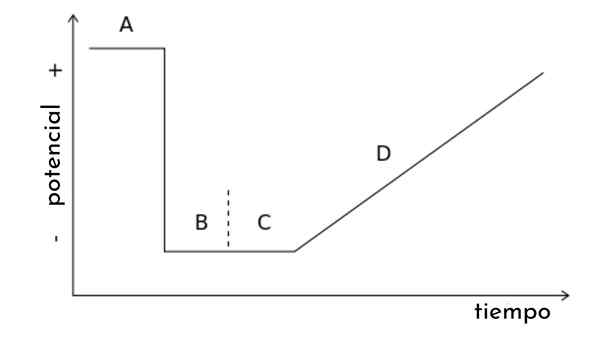
Dalam gambar artikel grafik ditampilkan. t, juga disebut gelombang potensial untuk voltamperometri pemindaian linier.
Dapat dilihat bahwa seiring berjalannya waktu, potensi meningkat. Pada gilirannya, sapuan ini menghasilkan kurva jawaban, atau voltamperaogram C vs. E, yang bentuknya akan sigmoid. Suatu titik akan datang di mana terlepas dari bagaimana itu meningkat, tidak akan ada peningkatan arus.
Jenis voltamperometri lainnya dapat disimpulkan dari grafik ini, memodifikasi gelombang potensial. t dengan potensi pulsa mendadak mengikuti pola tertentu. Setiap pola dikaitkan dengan jenis voltamperometri, dan mencakup teori dan kondisinya sendiri.
Voltamperometri pulsa
Dalam jenis voltamperometri ini Anda dapat menganalisis campuran dua atau lebih analit yang e e1/2 sangat dekat satu sama lain.
Dengan demikian, analit dengan E1/2 dari 0.04V dapat diidentifikasi di perusahaan orang lain dengan E1/2 dari 0.05V. Sementara dalam voltamperometry pemindaian linier, perbedaannya harus lebih besar dari 0.2v.
Oleh karena itu, ada sensitivitas yang lebih besar dan batas deteksi yang lebih rendah; yaitu, analit dapat ditentukan pada konsentrasi yang sangat rendah.
Gelombang potensial dapat memiliki pola yang sama dengan tangga, tangga miring, dan segitiga. Yang terakhir sesuai dengan voltamperometri siklus (CV).
Dapat melayani Anda: pembatasan dan reagen berlebihanDalam CV potensial dan berlaku dalam arti tertentu, positif atau negatif, dan kemudian, pada nilai E tertentu dalam waktu, potensi yang sama tetapi dalam arti yang berlawanan diterapkan kembali. Saat mempelajari voltampeogram yang dihasilkan, maksimum mengungkapkan keberadaan perantara dalam reaksi kimia.
Redisolution voltamperometry
Ini bisa dari tipe anodik atau katodik. Ini terdiri dari elektrodeposisi analit pada elektroda merkuri. Jika analit adalah ion logam (seperti CD2+), amalgam akan dibentuk; Dan jika itu anion (seperti moo42-), garam merkuri yang tidak larut.
Kemudian, potensi pulsa diterapkan untuk menentukan konsentrasi dan identitas spesies Electrodepos. Dengan demikian, amalgam adalah redisuelve, seperti garam merkuri.
Aplikasi Voltamperometry
- Voltamperometri redisolusi anodik digunakan untuk menentukan konsentrasi logam yang diselesaikan dengan cairan.
- Ini memungkinkan untuk mempelajari kinetika proses redoks atau adsorpsi, terutama ketika elektroda dimodifikasi untuk mendeteksi analit tertentu.
- Basis teoretisnya telah berfungsi untuk pembuatan biosensor. Dengan ini, keberadaan dan konsentrasi molekul biologis, protein, lemak, gula, dll. Dapat ditentukan.
- Akhirnya, ia mendeteksi partisipasi perantara dalam mekanisme reaksi.
Referensi
- González m. (2010). Voltamperometri. Dipulihkan dari: Kimia.LAGUIA2000.com
- Kimia dan Sains (2011). Voltamperometri. Diperoleh dari: Thequimica andlaciencia.Blogspot.com
- Quiroga a. (2017). Voltametri siklik. Pulih dari: chem.Librettexts.org
- Samuel p. Kouves (s.F.). Teknik voltametri. [PDF]. Universitas Tufts. Pulih dari: coklat.Edu
- Hari r. & Underwood a. Kimia analitik kuantitatif (Edisi kelima.). Pearson Prentice Hall.

