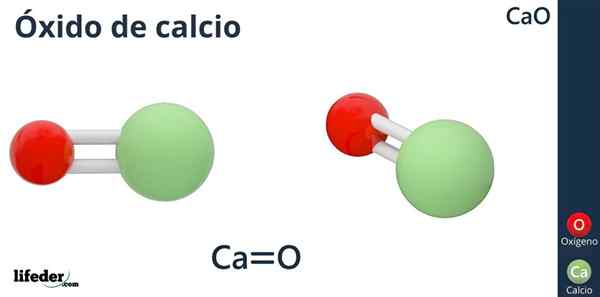
Kalsium oksida (CAO)
- 784
- 120
- Tommie Smith
Apa itu kalsium oksida?
Dia kalsium oksida (CAO) adalah senyawa anorganik yang mengandung kalsium dan oksigen dalam bentuk ionik (tidak membingungkan dengan kalsium peroksida, CAO2). Dibandingkan dengan duniawi sebagai kapur, kata yang menunjuk setiap senyawa anorganik yang mengandung karbonat, oksida dan kalsium hidroksida, selain logam lain seperti silikon, aluminium dan besi.
Ke oksida ini (atau jeruk nipis) juga merujuk bahasa sehari -hari sebagai hidup atau kapur, tergantung pada apakah itu terhidrasi atau tidak. Lime Lime adalah kalsium oksida, sedangkan kapur mati adalah hidroksidanya. Pada gilirannya, batu kapur (jeruk nipis atau jeruk nipis) sebenarnya merupakan batuan sedimen yang sebagian besar terdiri dari kalsium karbonat (CACO3).
Ini adalah salah satu sumber alami kalsium terbesar dan merupakan bahan baku untuk produksi kalsium oksida. Bagaimana oksida ini diproduksi? Karbonat rentan terhadap dekomposisi termal; Pemanasan kalsium karbonat pada suhu lebih besar dari 825 ºC, menyebabkan pembentukan kapur dan karbon dioksida.
Pernyataan sebelumnya dapat digambarkan sebagai berikut: Caco3(S) → CAO + CO2(G). Karena kerak bumi kaya akan batu kapur dan kalsit, dan di lautan dan pantai kerang laut (bahan baku untuk produksi kalsium oksida) berlimpah, kalsium oksida reagen yang relatif murah yang relatif murah murah murah.
Rumus
Formula kimia kalsium oksida adalah CAO, di mana kalsium seperti ion asam (akseptor elektron) CA2+, dan oksigen seperti ion dasar (donor elektron) atau2--.
Mengapa kalsium memiliki muatan +2? Karena kalsium milik kelompok 2 dari tabel periodik (SR. Scholambara), dan hanya memiliki dua elektron valensi yang tersedia untuk pembentukan tautan, yang menghasilkan atom oksigen.
Dapat melayani Anda: kalium oksida (k2o)Struktur kalsium oksida
 Struktur kristal kalsium oksida
Struktur kristal kalsium oksida Struktur kristal (jenis garam permata) untuk kalsium oksida diwakili dalam gambar atas. Bola merah tebal sesuai dengan ion Ca2+ dan bola putih ke ion atau2-.
Dalam pengaturan kristal kubik ini setiap ion ca2+ dikelilingi oleh enam ion atau2-, Terjadi di lubang oktahedral yang ditinggalkan oleh ion besar di antara mereka.
Struktur ini mengekspresikan maksimum karakter ionik oksida ini, meskipun perbedaan radio yang luar biasa (bola merah lebih besar dari putih) memberikan energi reticular kristal yang lebih lemah jika dibandingkan dengan MGO.
Sifat kalsium oksida
 Penampilan kalsium oksida
Penampilan kalsium oksida Secara fisik, ini adalah padatan putih kristal, toilet dan dengan interaksi elektrostatik yang kuat, yang bertanggung jawab atas titik merger tinggi (2572 ºC) dan mendidih (2850 ºC). Selain itu, ia memiliki berat molekul 55.958 g/mol dan sifat menarik dari termoluminescent.
Ini berarti bahwa sepotong kalsium oksida yang terpapar api dapat bersinar dengan cahaya putih yang intens, dikenal dalam bahasa Inggris dengan namanya PUSAT PERHATIAN, atau dalam bahasa Spanyol, cahaya kalsium. Ion ca2+, Dalam kontak dengan api, mereka berasal dari api kemerahan, seperti yang dapat dilihat pada gambar berikut.
 Cahaya kalsium atau pusat perhatian
Cahaya kalsium atau pusat perhatian Kelarutan
CAO adalah oksida dasar yang memiliki afinitas kuat untuk air, sampai tingkat yang menyerap kelembaban (ini adalah padatan higroskopis), bereaksi segera untuk menghasilkan dimatikan atau kalsium hidroksida:
Cao (s) + h2Atau (l) => ca (oh)2(S)
Reaksi ini bersifat eksotermik (menyerah panas) karena pembentukan padatan dengan interaksi yang lebih kuat dan jaringan kristal yang lebih stabil. Namun, reaksinya dapat dibalik jika CA (OH) dipanaskan2, mendehidrasi dan menyalakan jeruk nipis; Lalu, jeruk nipis "terlahir kembali".
Dapat melayani Anda: safranin: karakteristik, penggunaan, teknik, toksisitasSolusi yang dihasilkan sangat mendasar, dan jika jenuh dengan kalsium oksida mencapai pH 12,8.
Demikian juga, itu larut dalam gliserol dan larutan asam dan manis. Seperti oksida dasar, secara alami memiliki interaksi yang efektif dengan asam oksida (SiO2, Ke2SALAH SATU3 dan iman2SALAH SATU3, misalnya) menjadi larut dalam fase cair dari mereka. Di sisi lain, tidak larut dalam alkohol dan pelarut organik.
Penggunaan/Aplikasi
CAO memiliki penggunaan industri yang tak terhitung jumlahnya, serta dalam sintesis asetilena (CHHenalCH), dalam ekstraksi fosfat air limbah dan dalam reaksi dengan sulfur dioksida minuman ringan.
Penggunaan kalsium oksida lainnya dijelaskan di bawah ini:
Sebagai mortir
Jika kalsium oksida dicampur dengan pasir (sio2) dan air, kue dengan pasir dan bereaksi perlahan dengan air untuk membentuk kapur kusam. Pada gilirannya, CO2 Dari udara larut dalam air dan bereaksi dengan garam untuk membentuk kalsium karbonat:
CA (OH)2(s) + co2(g) => Caco3(s) + h2Atau (l)
Caco3 Ini adalah senyawa yang lebih tahan dan keras daripada CAO, menyebabkan mortar (campuran sebelumnya) mengeras dan memperbaiki batu bata, blok atau keramik di antara mereka atau ke permukaan yang diinginkan.
Dalam produksi kaca
Bahan baku esensial untuk produksi gelas adalah silikon oksida, yang dicampur dengan kapur, natrium karbonat (NA2BERSAMA3) dan aditif lainnya, dan kemudian mengalami pemanasan, menghasilkan padatan kaca. Padatan ini kemudian dipanaskan dan ditiup dalam gambar apa pun.
Dalam pertambangan
Kapur kusam menempati volume yang lebih besar daripada kapur hidup karena interaksi oleh jembatan hidrogen (O-H-O). Properti ini dieksploitasi untuk mematahkan batu dari dianggapnya.
Dapat melayani Anda: hidrogenasi katalitikIni dicapai dengan mengisinya dengan campuran kapur dan air yang ringkas, yang disegel untuk memfokuskan panasnya dan daya luas di dalam batu.
Sebagai agen penghapus silikat
CAO menyatu dengan silikat untuk membentuk cairan koalesen, yang kemudian diekstraksi dari bahan baku dari produk tertentu.
Misalnya, mineral besi adalah bahan baku untuk produksi besi dan baja logam. Mineral ini mengandung silikat, yang merupakan kotoran yang tidak diinginkan untuk proses dan dihilangkan dengan metode yang baru -baru ini dijelaskan.
Nanopartikel kalsium oksida
Kalsium oksida dapat disintesis sebagai nanopartikel, berbagai konsentrasi kalsium nitrat (CA (no3)2) dan natrium hidroksida (NaOH) dalam larutan.
Partikel -partikel ini bulat, dasar (serta skala padatan ke makro) dan memiliki banyak luas permukaan. Akibatnya, sifat -sifat ini menguntungkan proses katalitik. Yang? Investigasi saat ini menjawab pertanyaan itu.
Nanopartikel ini telah digunakan untuk mensintesis senyawa organik tersubstitusi - yang berasal dari piridin - dalam perumusan obat baru untuk melakukan transformasi kimia seperti fotosintesis buatan, untuk pemurnian air dari logam yang berat dan berbahaya, dan sebagai agen fotokatalitik yang berat,.
Nanopartikel dapat disintesis pada dukungan biologis, seperti pepaya dan daun teh hijau, untuk memberikannya sebagai agen antibakteri.
Referensi
- Scifun.org. (2018). Lime: kalsium oksida. Pulih dari: scifun.org.
- Wikipedia. (2018). Kalsium oksida. Diperoleh dari: di.Wikipedia.org
- Pubchem. (2018). Kalsium oksida. Pulih dari: pubchem.NCBI.Nlm.Nih.Pemerintah
- Shiver & Atkins. (2008). Kimia anorganik. Di dalam Elemen Grup 2. (edisi keempat., P. 280). MC Graw Hill.