Struktur timah oksida (II), sifat, nomenklatur, penggunaan

- 3484
- 1072
- Pete Lesch
Dia Tin Oksida (II) Ini adalah padatan anorganik kristal yang dibentuk oleh oksidasi timah (SN) oleh oksigen, di mana timah memperoleh valencia 2+. Formula kimianya adalah Sno. Dua cara berbeda dari senyawa ini diketahui: hitam dan merah. Bentuk umum dan paling stabil pada suhu kamar adalah modifikasi hitam atau biru.
Bentuk ini disiapkan oleh hidrolisis timah klorida (II) (SNCl2) Dalam larutan berair, di mana amonium hidroksida ditambahkan (NH4OH) Untuk mendapatkan endapan oksida terhidrasi dari SN (II) yang formulanya SNO.Xh2Atau, di mana x<1 (x menor que 1).
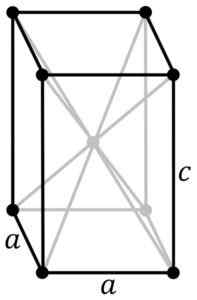 Struktur kristal tetragonal dari sno biru-biru. Atom SN terletak di tengah struktur dan atom oksigen di simpul paralelelepiped. PNG asli oleh pengguna: rocha, ditelusuri di Inkscape oleh pengguna: stannered [cc by-sa 3.0 (http: // createveCommons.Org/lisensi/by-sa/3.0/]] Sumber: Wikipedia Commons
Struktur kristal tetragonal dari sno biru-biru. Atom SN terletak di tengah struktur dan atom oksigen di simpul paralelelepiped. PNG asli oleh pengguna: rocha, ditelusuri di Inkscape oleh pengguna: stannered [cc by-sa 3.0 (http: // createveCommons.Org/lisensi/by-sa/3.0/]] Sumber: Wikipedia Commons Oksida terhidrasi adalah padatan amorf putih, yang kemudian dipanaskan dalam suspensi hingga 60-70 ºC selama beberapa jam di hadapan NH4Oh, sampai Anda mendapatkan sno murni kristal hitam.
Bentuk merah SNO adalah metastable. Itu bisa disiapkan dengan menambahkan asam fosfat (h3PO4) - dengan 22% asam fosfor, h3PO3 - Dan kemudian nh4Oh solusi sncl2. Padatan putih yang diperoleh dipanaskan dalam larutan yang sama hingga 90-100 ºC selama sekitar 10 menit. Dengan cara ini SNO kristal merah murni diperoleh.
Tin oksida (II) adalah bahan awal untuk produksi senyawa timah lainnya (II). Karena alasan ini, ini adalah salah satu senyawa timah yang memiliki kepentingan komersial yang cukup besar.
Tin oksida (II) menyajikan toksisitas rendah seperti kebanyakan senyawa timah -inorganik. Ini karena penyerapannya yang buruk dan ekskresi kain makhluk hidup yang cepat.
Itu dapat melayani Anda: bipe beraral: apa itu, karakteristik, untuk apa ituMenyajikan salah satu toleransi senyawa timah terbesar dalam tes yang dilakukan dengan tikus. Namun, itu bisa berbahaya jika dihirup dalam jumlah besar.
[TOC]
Struktur
Timah oksida (ii) biru-biru
Modifikasi ini mengkristal dengan struktur tetragonal. Itu memiliki pengaturan lapisan.
Peneliti lain menegaskan bahwa setiap atom SN dikelilingi oleh 5 atom oksigen yang kira -kira berada di simpul oktahedron, di mana simpul keenam mungkin ditempati oleh sepasang elektron gratis atau tidak dipasangkan. Ini dikenal sebagai pengaturan φ-oktik.
Oksida timah merah (II)
Bentuk timah oksida (II) ini mengkristal dengan struktur ortorombik.
Tata nama
- Tin Oksida (II)
- Estany oksida
- Timah monoksida
- Estany oksida
Properti
Keadaan fisik
Kristal padat.
Berat molekul
134.71 g/mol.
Titik lebur
1080 ºC. Itu membusuk.
Kepadatan
6.45 g/cm3
Kelarutan
Tidak larut dalam air dingin atau panas. Tidak larut dalam metanol, tetapi larut dengan cepat dalam asam dan alkali pekat.
Properti lainnya
Jika lebih dari 300 ºC dipanaskan di hadapan udara, oksida timah (II) dengan cepat teroksidasi dalam oksida timah (IV) yang menghadirkan pijar.
Telah dilaporkan bahwa dalam kondisi non-oksidan, pemanasan timah (II) memiliki berbagai hasil sesuai dengan tingkat kemurnian oksida awal. Ini umumnya tidak proporsional dalam SN logam dan oksida timah (IV), SNO2, Dengan berbagai spesies perantara yang akhirnya menjadi sno2.
Timah oksida (ii) adalah amfotero, karena dilarutkan dalam asam untuk memberikan ion SN2+ atau kompleks anion, dan juga larut dalam alkali untuk membentuk solusi ion pemindahan hidroksi, SN (OH)3-, yang memiliki struktur piramidal.
Itu dapat melayani Anda: asam perklorik: formula, karakteristik dan penggunaanSelain itu, SNO adalah zat pereduksi dan bereaksi dengan cepat dengan asam dan mineral organik.
Ini menyajikan toksisitas rendah jika dibandingkan dengan garam timah lainnya. DL50 -nya (dosis mematikan 50% atau dosis mematikan sedang) pada tikus lebih dari 10.000 mg/kg. Ini berarti bahwa lebih dari 10 gram per kilogram diperlukan untuk membunuh 50% spesimen tikus dalam masa percobaan tertentu. Sebagai perbandingan, timah fluoride (II) menyajikan 188 mg/kg DL50.
Namun, jika dihirup untuk waktu yang lama, itu disimpan di paru -paru karena tidak diserap dan dapat menghasilkan timah (infiltrasi debu Sno di celah paru).
Aplikasi
Dalam produksi senyawa timah lainnya (II)
Reaksi cepatnya dengan asam adalah dasar dari penggunaannya yang paling penting, yang merupakan perantara dalam pembuatan senyawa timah lainnya.
Ini digunakan dalam produksi timah bromida (II) (SNBR2), Timah sianida (II) (SN (CN)2) dan hidrat fluoroborat timah (II) (SN (BF4)2), Di antara senyawa timah lainnya (ii).
Tin Fluoroborate (II) disiapkan dengan melarutkan SNAM. Ini disebabkan, antara lain, karena kapasitas cakupannya yang tinggi.
Tin (II) oksida juga digunakan dalam preparasi timah sulfat (II) (SNSO4), dengan sno dan reaksi asam sulfat, h2Sw4.
Snso4 Diperoleh, digunakan dalam proses kaleng untuk produksi pelat sirkuit cetak, untuk lapisan kontak listrik dan untuk peralatan dapur.
Dapat melayani Anda: aluminium karbonat: struktur, sifat, penggunaan Sirkuit cetak. Tidak ada penulis yang dapat dibaca mesin. Abraham del Pozo diasumsikan (berdasarkan klaim hak cipta). [Domain publik] Sumber: Wikimedia Commons
Sirkuit cetak. Tidak ada penulis yang dapat dibaca mesin. Abraham del Pozo diasumsikan (berdasarkan klaim hak cipta). [Domain publik] Sumber: Wikimedia Commons Bentuk terhidrasi dari SNO, Tin Hydrotado (II) SNO.Xh2Atau, diobati dengan asam fluorhorority untuk mendapatkan timah fluorida (II), SNF2, yang ditambahkan ke krim denifrik sebagai agen untuk memerangi karies.
Dalam perhiasan
Tin oksida (II) digunakan dalam persiapan kristal peregangan emas dan tembaga. Rupanya fungsinya dalam aplikasi ini adalah bertindak sebagai agen peredam.
 Permata dengan Ruby. Sumber: Pixabay
Permata dengan Ruby. Sumber: Pixabay Penggunaan lainnya
Ini telah digunakan dalam perangkat fotovoltaik untuk produksi listrik dari cahaya, seperti sel surya.
 Perangkat fotovoltaik. Georg Slickers [CC BY-SA 2.5 (https: // createveCommons.Org/lisensi/by-sa/2.5)] Sumber: Wikipedia Commons
Perangkat fotovoltaik. Georg Slickers [CC BY-SA 2.5 (https: // createveCommons.Org/lisensi/by-sa/2.5)] Sumber: Wikipedia Commons Inovasi terbaru
Nanopartikel yang dipesan SNO telah digunakan dalam elektroda karbon nanotube untuk baterai lithium-sugar.
 SNO Hydrate Nanofibers. Fionán [cc by-sa 4.0 (https: // createveCommons.Org/lisensi/by-sa/4.0)] Sumber: Wikipedia Commons
SNO Hydrate Nanofibers. Fionán [cc by-sa 4.0 (https: // createveCommons.Org/lisensi/by-sa/4.0)] Sumber: Wikipedia Commons Elektroda SNO yang disiapkan menunjukkan konduktivitas tinggi dan sedikit perubahan volume dalam siklus pemuatan dan unduhan yang berulang.
Selain itu, SNO memfasilitasi transfer ion/elektron yang cepat selama reaksi pengurangan oksidasi yang terjadi dalam sistem baterai tersebut.
Referensi
- Kapas, f. Albert dan Wilkinson, Geoffrey. (1980). Kimia anorganik canggih. Edisi keempat. John Wiley & Sons.
- Dance, J.C.; Emeléus, h.J.; Sir Ronald Nyholm dan Trotman-Deckenson,.F. (1973). Kimia anorganik yang komprehensif. Volume 2. Pergamon Press.
- Ensiklopedia Kimia Industri Ullmann. (1990). Edisi Kelima. Volume A27. Vch verlagsgellschaft mbh.
- Kirk-Othmer (1994). Encyclopedia of Chemical Technology. Volume 24. Edisi keempat. John Wiley & Sons.
- Ostrakhovitch, elena ke. Dan Cherian, m. George. (2007). Timah. Dalam Buku Pegangan Toksikologi Logam. Edisi ketiga. Pulih dari scientedirect.com.
- Kwestroo, w. dan vromans, p.H.G.M. (1967). Persiapan tiga modifikasi timah murni (II) oksida. J. Inorg. Nucl. Chem., 1967, Vol.29, hlm.2187-2190.
- Foud, s.S et al. (1992). Sifat optik film tipis oksida stannous. Jurnal Fisika Cekoslowak. Februari 1992, Volume 42, Edisi 2. Pulih dari springer.com.
- A-Young Kim et al. (2017). Memesan nanopartikel SNO di MWCNT sebagai bahan host fungsional untuk katoda baterai lithium-sulfur tingkat tinggi. Nano Research 2017, 10 (6). Pulih dari springer.com.
- Perpustakaan Kedokteran Nasional. (2019). Oksida stannous. Pulih dari: pubchem.NCBI.Nlm.Nih.Pemerintah
- « Riwayat alat tenun jacquard, operasi, penggunaan
- Fungsionalisme (Arsitektur) Sejarah, Karakteristik, Karya »

