Struktur Strontium oksida (SRO), sifat, aplikasi

- 1003
- 208
- Herbert Fritsch
Kami menjelaskan apa strontium oksida, struktur kimianya, sifat fisik dan kimia, aplikasi dan risiko
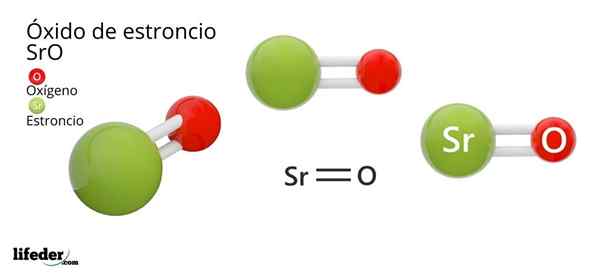
Dia Strontium oksida, Formulanya kimianya adalah SRO (jangan disamakan dengan strontium peroksida, yaitu SRO2), adalah produk dari reaksi oksidatif antara logam ini dan oksigen yang ada di udara pada suhu kamar: 2SR (S) + O2 (g) → 2sro (s).
Sepotong strontium membakar yang bersentuhan dengan udara sebagai akibat dari reaktivitas tinggi, dan karena memiliki konfigurasi elektronik tipe NS2, dua elektron valensi dengan mudah menghasilkan, terutama molekul oksigen diatomik.
Jika luas permukaan logam ditambah dengan menyemprotkannya sampai memiliki bubuk yang terbagi halus, reaksi segera terjadi, dan bahkan terbakar dengan nyala api kemerahan yang kuat. Strontium, logam yang berpartisipasi dalam reaksi ini, adalah logam dari kelompok 2 dari tabel periodik.
Kelompok ini terdiri dari unsur -unsur yang dikenal sebagai alkali. Yang pertama dari elemen yang dipimpin oleh kelompok adalah berilium, diikuti oleh magnesium, kalsium, strontium, barium, dan akhirnya, radio. Elemen -elemen ini bersifat logam dan, sebagai aturan mnemonik untuk mengingatnya, ekspresi dapat digunakan: “SR. Becambara ".
"MR" yang dirujuk ekspresi tidak lain adalah strontium logam (SR), elemen kimia yang sangat reaktif yang secara alami tidak ditemukan dalam bentuk murni, tetapi dikombinasikan dengan elemen lain dari lingkungan atau lingkungannya untuk memunculkan Garam, nitrida, dan oksida.
Untuk alasan ini, mineral dan strontium oksida adalah senyawa di mana strontium ditemukan di alam.
[TOC]
Sifat fisik dan kimia strontium oksida
 Penampilan fisik strontium oksida
Penampilan fisik strontium oksida Strontium oksida adalah senyawa putih solid, berpori dan toilet dan, tergantung pada perawatan fisiknya, dapat ditemukan di pasaran sebagai debu halus, seperti kristal atau nanopartikel.
Dapat melayani Anda: oksidaBerat molekulnya adalah 103.619 g/mol dan memiliki indeks bias yang tinggi. Ini memiliki titik fusi (2531 ºC) dan mendidih (3200 ° C), yang diterjemahkan ke dalam interaksi tautan yang kuat antara strontium dan oksigen. Titik leleh yang tinggi ini membuatnya menjadi bahan yang stabil secara termal.
Oksida dasar
Ini adalah oksida yang sangat mendasar; Ini berarti bereaksi pada suhu kamar dengan air untuk membentuk strontium hidroksida (SR (OH) 2):
SRO (S) + H2O (L) → SR (OH) 2
Kelarutan
Ini juga bereaksi atau mempertahankan kelembaban, karakteristik esensial senyawa higroskopis. Oleh karena itu, strontium oksida memiliki reaktivitas tinggi dengan air.
Dalam pelarut lain - misalnya, alkohol seperti etanol apotek atau metanol - sedikit larut; Sedangkan dalam pelarut seperti aseton, eter atau diklorometana, itu tidak larut.
Mengapa seperti ini? Karena logam oksida -dan bahkan lebih banyak yang terbentuk dari logam alkalinotherrous -senyawa kutub dan karenanya berinteraksi dengan tingkat yang lebih baik dengan pelarut kutub.
Tidak hanya dapat bereaksi dengan air, tetapi juga dengan karbon dioksida, menghasilkan strontium karbonat:
SRO (S) + CO2 (G) → SRCO3 (S)
Bereaksi dengan asam - seperti misalnya, asam fosfat encer - untuk menghasilkan garam dan air fosfat garam:
3SRO (S) + 2 H3PO4 (DIL) → SR3 (PO4) 2 (S) + 3H2O (g)
Reaksi ini eksotermik, itulah sebabnya air yang dihasilkan diuapkan oleh suhu tinggi.
Struktur kimia
Struktur kimia suatu senyawa menjelaskan seperti apa atom -atomnya di ruang angkasa. Dalam kasus strontium oksida, ini menyajikan struktur kristal jenis garam permata, garam meja yang sama atau natrium klorida (NaCl).
Dapat melayani Anda: kalsium bikarbonatTidak seperti NaCl, garam monovalen -yaitu, dengan kation dan anion dengan besarnya beban (+1 untuk Na dan -1 untuk CL) -, SRO adalah divalen, dengan 2+ beban untuk SR, dan dari -2 untuk O (o2-, anion oksida).
Dalam struktur ini masing-masing ion O2- (merah) dikelilingi oleh enam oksida besar lainnya, hosting di interstipes oktahedral yang dihasilkan dari ion SR2+ (warna hijau), lebih kecil. Kemasan atau pengaturan ini dikenal sebagai sel kesatuan kubik yang berpusat pada wajah (CCC).
Jenis tautan
Formula kimia strontium oksida adalah SRO, tetapi tidak sepenuhnya menjelaskan struktur kimia atau tipe tautan yang ada.
Pada bagian sebelumnya disebutkan bahwa ia menyajikan struktur garam GEMA; yaitu, struktur kristal yang sangat umum untuk banyak garam.
Oleh karena itu, jenis tautan sebagian besar ionik, yang akan mengklarifikasi mengapa oksida ini memiliki fusi tinggi dan titik didih.
Karena tautannya adalah ionik, interaksi elektrostatik yang menyatukan atom strontium dan oksigen: Sr2+ O2-.
Jika ikatan ini kovalen, senyawa dapat diwakili dengan tautan dalam struktur Lewisnya (menghilangkan elektron oksigen yang tidak dibagikan).
Aplikasi
Sifat fisik suatu senyawa sangat penting untuk memprediksi apa aplikasi potensial mereka dalam industri; Oleh karena itu, ini adalah refleksi makro dari sifat kimianya.
Pengganti timbal
Strontium oksida, berkat stabilitas termal yang tinggi, menemukan banyak aplikasi dalam industri keramik, kaca dan optik.
Penggunaannya dalam industri ini terutama dimaksudkan untuk menggantikan timah dan menjadi aditif yang memberikan warna dan viskositas yang lebih baik pada bahan baku produk.
Dapat melayani Anda: sewa halogenuros: properti, mendapatkan, contohProduk yang mana? Daftar ini tidak akan memiliki akhir, karena dalam hal ini yang memiliki kaca, enamel, keramik atau kristal di salah satu potongannya, strontium oksida mungkin berguna.
Industri Aerospace
Karena ini adalah padatan yang sangat berpori, ia dapat mengintereperasi partikel yang lebih kecil, dan dengan demikian memberikan berbagai kemungkinan dalam perumusan bahan, sebagaimana dipertimbangkan oleh industri kedirgantaraan.
Katalisator
Porositas yang sama memungkinkan Anda untuk memiliki potensi penggunaan sebagai katalis (akselerator reaksi kimia) dan sebagai penukar panas.
Tujuan elektronik
Strontium oksida juga berfungsi sebagai sumber produksi strban murni untuk keperluan elektronik, berkat kemampuan logam ini untuk menyerap x -rays; Dan untuk persiapan industri hidroksida, Sr (OH) 2, dan peroksida, SRO2.
Resiko kesehatan
Ini adalah senyawa korosif, sehingga dapat menyebabkan luka bakar dengan kontak fisik sederhana di mana saja di dalam tubuh. Ini sangat sensitif terhadap kelembaban dan harus disimpan di ruang kering dan dingin.
Produk garam dari reaksi oksida ini dengan asam yang berbeda berperilaku dalam tubuh serta sebagai garam kalsium, dan disimpan atau dikeluarkan oleh mekanisme yang sama.
Pada saat itu, Strontium oksida dengan sendirinya tidak mewakili risiko kesehatan yang lebih besar.
Referensi
- Elemen Amerika. (1998-2018). Elemen Amerika. Pulih dari Amerika.com
- Shiver & Atkins. (2008). Kimia anorganik. Dalam struktur padatan sederhana (ed keempat., P. 84). MC Graw Hill.
- Atsdr. Pulih dari asdr: atsdr.CDC.Pemerintah
- Clark, J. (2009). ChemGuide. Pulih dari chemguide.bersama.Inggris
- Tiwary, r., Narayan, s., & Pandey, atau. (2007). Persiapan Stontium Oksida dari Celestite: A Review. Ilmu Bahan, 201-211.

