Struktur fosfor oksida (V), sifat, memperoleh, penggunaan, risiko

- 2823
- 101
- Mr. Darrell Streich
Dia Fosfor oksida (V) Ini adalah padatan anorganik yang dibentuk oleh fosfor (P) dan oksigen (O). Formula empirisnya adalah p2SALAH SATU5, sedangkan formula molekul yang benar adalah p4SALAH SATU10. Ini adalah padatan putih yang sangat higroskopis, yaitu, dapat menyerap udara dari udara dengan sangat mudah, segera bereaksi dengan ini. Reaksi bisa berbahaya karena menyebabkan peningkatan suhu yang cepat.
Kecenderungan tinggi untuk menyerap air telah menyebabkannya digunakan sebagai zat pengeringan di laboratorium kimia, serta mendehidrasi beberapa senyawa, yaitu, untuk menghilangkan air dari molekulnya.
 Bubuk fosfor oksida (v), p4SALAH SATU10. LHCHEM [CC BYS-S (https: // CreationCommons.Org/lisensi/by-sa/3.0)]. Sumber: Wikimedia Commons.
Bubuk fosfor oksida (v), p4SALAH SATU10. LHCHEM [CC BYS-S (https: // CreationCommons.Org/lisensi/by-sa/3.0)]. Sumber: Wikimedia Commons. Fosfor oksida (V) juga digunakan untuk mempercepat reaksi pengikatan molekul berbagai hidrokarbon, menjadi reaksi yang disebut kondensasi. Selain itu, memungkinkan untuk mengubah asam organik tertentu menjadi ester.
Ini telah digunakan misalnya untuk memperbaiki bensin, untuk menyiapkan asam fosfat H3PO4, Untuk mendapatkan senyawa yang berfungsi untuk menunda api, untuk memproduksi kaca untuk aplikasi vakum, di antara banyak kegunaan lainnya.
Fosfor oksida (V) harus disimpan dalam wadah yang ditutup dengan baik untuk mencegah kontak dengan kelembaban dari udara. Itu korosif dan dapat membahayakan mata, kulit dan lendir.
[TOC]
Struktur
Fosfor oksida (V) dibentuk oleh fosfor (P) dan oksigen (O), di mana fosfor memiliki valensi +5 dan oksigen -2. Fosfor oksida molekul (V) memiliki empat fosfor dan sepuluh atom oksigen dan itulah sebabnya formula molekulnya yang benar adalah p adalah p adalah p adalah p adalah p adalah p adalah p adalah p adalah p4SALAH SATU10.
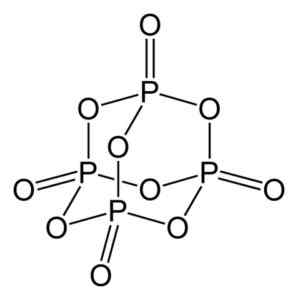 Struktur molekul fosfor oksida (V), p4SALAH SATU10. Penulis: Benjah-BMM27. Sumber: Wikimedia Commons.
Struktur molekul fosfor oksida (V), p4SALAH SATU10. Penulis: Benjah-BMM27. Sumber: Wikimedia Commons. Ada dalam tiga bentuk kristal, seperti debu amorf dan dalam bentuk vitreous (seperti kaca). Dalam bentuk kristal heksagonal, masing -masing atom fosfor ditemukan di simpul tetrahedron.
Tata nama
- Fosfor oksida (V)
- Fosfor pentoksida
- Pentoksida difosfack
Dapat melayani Anda: pelarut: konsep, jenis dan contoh- Pentoksida fosfat
- Anhidrida fosfor
- Pembusukan Tetrafosfor
Properti
Keadaan fisik
Solid putih kristal. Bentuk yang paling umum adalah kristal heksagonal.
Berat molekul
283.89 g/mol
Titik lebur
562 ºC
Suhu sublimasi
360 ºC hingga 1 atmosfer tekanan. Itu berarti bahwa pada suhu ini mengalir dari padatan gas tanpa melalui keadaan cair.
Kepadatan
2,30 g/cm3
Kelarutan
Sangat larut dalam air. Asam sulfat larut. Tidak larut dalam aseton dan amonia.
Sifat kimia
Fosfor oksida (V) menyerap dan bereaksi dengan udara dari udara dengan asam fosfat yang terbentuk dengan cepat3PO4. Reaksi ini eksotermik, yang berarti panas diproduksi selama yang sama.
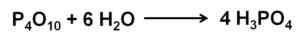 Reaksi fosfor (V) oksida dengan air untuk membentuk asam fosfat H3PO4. Penulis: Marilú Stea.
Reaksi fosfor (V) oksida dengan air untuk membentuk asam fosfat H3PO4. Penulis: Marilú Stea. Reaksi p4SALAH SATU10 dengan air mengarah pada pembentukan campuran asam fosfat yang komposisinya tergantung pada jumlah air dan kondisi.
Reaksi dengan alkohol mengarah pada pembentukan asam fosfat atau ester asam polimerik tergantung pada kondisi eksperimental.
P4SALAH SATU10 + 6 ROH → 2 (RO)2PO.Oh + 2 ro.PO (OH)2
Dengan oksida dasar membentuk fosfat padat.
Itu korosif. Ini dapat bereaksi berbahaya dengan asam format dan basa anorganik seperti natrium hidroksida (NaOH), kalsium oksida (CAO) atau natrium karbonat NA2BERSAMA3.
Jika larutan asam perklorat HCLO dituangkan4 dan chloroform chcl3 Dalam fosfor oksida (v) p4SALAH SATU10 Ledakan kekerasan terjadi.
Properti lainnya
Itu tidak mudah terbakar. Tidak menyukai pembakaran. Namun, reaksi airnya sangat kejam dan eksotermik sehingga mungkin ada risiko kebakaran.
Memperoleh
Itu dapat disiapkan dengan oksidasi fosfor langsung dalam arus udara kering. Fosfor Saat Kontak Kelebihan Oksigen Dioksidasi Membentuk Fosfor Oksida (V).
P4 + 5 o2 → p4SALAH SATU10
Kehadiran di alam
Fosfor oksida (V) ditemukan dalam mineral seperti ilmenite, rutilo dan zircón.
Dapat melayani Anda: apa fungsi kimia anorganik?Ilmenite adalah mineral yang mengandung zat besi dan titanium dan kadang -kadang memiliki fosfor (V) oksida dalam konsentrasi yang bervariasi antara 0,04 dan 0,33% berat. Rutilo adalah mineral titanium oksida dan dapat mengandung sekitar 0,02% berat p2SALAH SATU5.
Zircón Sands (mineral unsur zirkonium) memiliki fosfor (V) oksida pada 0,05-0,39% berat.
Aplikasi
Sebagai agen dehidrasi dan penjahitan
Karena aviditasnya yang besar untuk air, ini adalah salah satu agen dehidrasi yang paling terkenal dan sangat efektif pada suhu yang lebih kecil dari 100 ° C.
Dapat mengekstrak air dari zat yang dianggap sebagai agen dehidrasi. Misalnya, Anda dapat menghilangkan air dari asam sulfat H2Sw4 membuatnya begitu3 dan asam nitrat hno3 mengubahnya menjadi n2SALAH SATU5.
 Dehidrasi asam sulfat karena fosfor oksida (V). Penulis: Marilú Stea.
Dehidrasi asam sulfat karena fosfor oksida (V). Penulis: Marilú Stea. Pada dasarnya dapat mengeringkan semua cairan dan gas yang tidak bereaksi, sehingga memungkinkan untuk menghilangkan jejak kelembaban dari sistem vakum.
Dalam reaksi kimia organik
Fosfor oksida (V) berfungsi untuk menutup cincin senyawa organik dan reaksi kondensasi lainnya.
Hal ini memungkinkan untuk memusatkan asam organik dengan kemungkinan membedakan antara asam karboksilat alifatik primer (rantai berkarbonasi tanpa cincin dengan kelompok -COOH di satu ujung) dan asam aromatik (kelompok -COH yang terkait dengan cincin benzena), karena yang terakhir tidak bereaksi.
Itu juga berfungsi untuk menghilangkan molekul H2Atau Amidas r (c = o) nh2 Dan itu membuat mereka nitril R-CN. Selain itu, mengkatalisasi atau mempercepat oksigenasi, dehidrogenasi dan polimerisasi reaksi bitumen.
 P4SALAH SATU10 Ini banyak digunakan di laboratorium kimia organik. Penulis: JDN2001CN0. Sumber: Pixabay.
P4SALAH SATU10 Ini banyak digunakan di laboratorium kimia organik. Penulis: JDN2001CN0. Sumber: Pixabay. Dalam pemurnian bahan bakar
Sejak 1930 -an abad kedua puluh, studi tertentu menunjukkan bahwa fosfor (V) oksida memberikan aksi pemurnian gas, meningkatkan oktannya.
Tindakan pemurnian p4SALAH SATU10 Ini terutama karena reaksi kondensasi (penyatuan molekul yang berbeda) dan bukan polimerisasi (pengikatan molekul yang sama).
Dapat melayani Anda: natrium asetat: struktur, sifat, sintesis, penggunaanP4SALAH SATU10 Mempercepat hidrokarbon alomatik langsung dengan hidrokarbon olefin, konversi olefin menjadi afhtens dan polimerisasi parsial. Reaksi alkilasi meningkatkan jumlah oktan bensin.
Dengan cara ini, bensin olahan berkualitas tinggi diperoleh.
 Beberapa turunan minyak dapat ditingkatkan dengan tindakan p4SALAH SATU10 Dalam molekulnya. Penulis: Drpeperscott230. Sumber: Pixabay.
Beberapa turunan minyak dapat ditingkatkan dengan tindakan p4SALAH SATU10 Dalam molekulnya. Penulis: Drpeperscott230. Sumber: Pixabay. Dalam berbagai aplikasi
Fosfor oksida (V) melayani:
- Siapkan asam fosfat H3PO4
- Dapatkan ester akrilat dan surfaktan
- Siapkan ester fosfat yang digunakan sebagai retarder api, pelarut dan pengenceran
- Konversi fosfor triklorida menjadi fosfor oksiklorida
- Reagen laboratorium
- Buat gelas khusus untuk tabung vakum
- Tingkatkan titik leleh aspal
- Berfungsi sebagai molekul standar dalam penentuan fosfor atau fosfat dalam batuan fosfat, pupuk dan semen Portland, dalam bentuk p2SALAH SATU5
- Meningkatkan hubungan antara polimer tertentu dan lapisan gading yang dimiliki gigi
 Beberapa gelas khusus seperti tabung vakum perlu menggunakan p4SALAH SATU10 Selama pembuatannya. Tvezymer [domain publik]. Sumber: Wikimedia Commons.
Beberapa gelas khusus seperti tabung vakum perlu menggunakan p4SALAH SATU10 Selama pembuatannya. Tvezymer [domain publik]. Sumber: Wikimedia Commons. Risiko
Fosfor oksida (V) harus dipertahankan dalam wadah tertutup dan di tempat segar, kering dan berventilasi baik.
Ini berfungsi untuk mencegahnya untuk tidak menghubungi air, karena dapat bereaksi keras dengan itu, menghasilkan sangat panas, ke titik pembakaran bahan terdekat yang mudah terbakar.
Fosfor oksida (V) Debu mengiritasi mata dan saluran pernapasan dan korosif untuk kulit. Itu bisa menghasilkan luka bakar di mata. Dengan konsumsi menyebabkan luka bakar internal yang fatal.
Referensi
- ATAU.S. Perpustakaan Kedokteran Nasional. (2019). Anhidrida fosfor. Pulih dari pubchem.NCBI.Nlm.Nih.Pemerintah.
- Nayler, hlm. (2001). Bitumens: Dimodifikasi. Modifikasi kimia. Dalam Encyclopedia of Material: Sains dan Teknologi. Pulih dari scientedirect.com.
- MALISHEV, b.W. (1936). Fosfor pentoksida sebagai agen pemurnian untuk bensin. Kimia Industri & Teknik 1936, 28, 2, 190-193. Pulih dari pub.ACS.org.
- Epps, jr. DAN.KE. (1950). Penentuan fotometrik fosfor pentoksida yang tersedia dalam pupuk. Kimia Analitik 1950, 22, 8, 1062-1063. Pulih dari pub.ACS.org.
- Banerjee, a. et al. (1983). Penggunaan fosfor pentoksida: esterifikasi asam organik. J. Org. Chem. 1983, 48, 3108-3109. Pulih dari pub.ACS.org.
- Kapas, f. Albert dan Wilkinson, Geoffrey. (1980). Kimia anorganik canggih. Edisi keempat. John Wiley & Sons.
- Kirk-Othmer (1994). Encyclopedia of Chemical Technology. Edisi keempat. John Wiley & Sons.
- Ogliari, f.KE. et al. (2008). Sintesis monomer fosfat dan ikatan dengan dentin: metode esterifikasi dan penggunaan fosfor pentoksida. Jurnal Kedokteran Gigi, Volume 36, Edisi 3, Maret 2008, Halaman 171-177. Pulih dari scientedirect.com.
- « Aluminium asetat (Al (CH3CO) 3) Struktur, sifat, penggunaan
- Notasi mengembangkan apa adanya, contoh dan latihan »

