Lithium oksida
- 4416
- 1
- Leland Robel
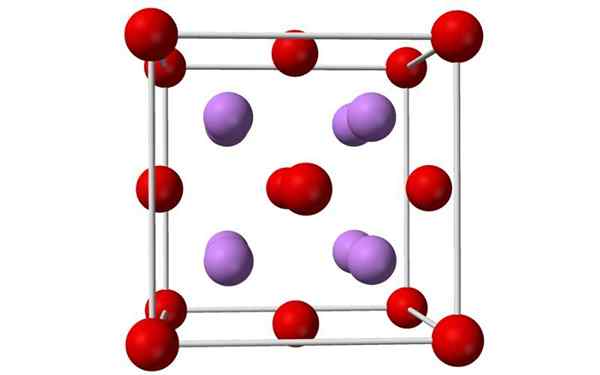
 Bola dan batang model sel lithium oksida kesatuan. Sumber: Benjah-BMM27, Wikimedia Commons
Bola dan batang model sel lithium oksida kesatuan. Sumber: Benjah-BMM27, Wikimedia Commons Apa itu lithium oksida?
Dia Lithium oksida Ini adalah senyawa kimia anorganik dari formula li2Atau itu terbentuk bersama dengan sejumlah kecil lithium peroksida ketika logam lithium dibakar di udara dan bergabung dengan oksigen.
Sampai tahun 90 -an, pasar logam dan lithium didominasi oleh produksi AS dari deposit mineral, tetapi pada awal abad ke -21 sebagian besar produksi berasal dari sumber lain: Australia, Chili dan Portugal adalah pemasok terpenting di dunia. Bolivia memiliki setengah dari endapan lithium di dunia, tetapi itu bukan produsen yang hebat.
Bentuk komersial terpenting adalah lithium carbonate, li2BERSAMA3, Diproduksi dari mineral atau salmuela dengan beberapa proses yang berbeda.
Saat lithium terbakar di udara, produk utamanya adalah lithium oksida putih, Li2SALAH SATU. Selain itu, beberapa lithium peroksida terjadi, li2SALAH SATU2, Juga putih.
Ini juga dapat dilakukan melalui dekomposisi termal lithium hidroksida, lioh, atau lithium peroksida, li2SALAH SATU2.
4li + o2(g) → 2li2Anda)
2lioh + panas → li2Atau (s) + h₂o (g)
2li2SALAH SATU2(s) + panas → 2li2Atau (s) + atau2(G)
Sifat fisik dan kimia
- Lithium oksida adalah padatan putih yang dikenal sebagai lithia, yang tidak memiliki aroma dan memiliki rasa asin.
- Lithium oksida adalah kristal dengan geometri antiflorite, mirip dengan natrium klorida (kubik yang berpusat pada wajah).
- Berat molekulnya adalah 29,88 g/mol, kepadatannya adalah 2,013 g/ml dan titik -titik fusi dan didih masing -masing adalah 1438 ° C dan 2066 ° C.
Itu bisa melayani Anda: epid- Senyawa ini sangat larut dalam air, alkohol, eter, piridin dan nitrobenzene.
- Lithium oksida bereaksi dengan mudah dengan uap air untuk membentuk hidroksida, dan karbon dioksida untuk membentuk karbonat; Oleh karena itu, harus disimpan dan dikelola dalam suasana yang bersih dan kering.
- Senyawa oksida tidak menghantarkan listrik. Namun, oksida terstruktur tertentu dari perovskita adalah konduktif elektronik yang menemukan aplikasi dalam katoda sel bahan bakar oksida padat dan sistem pembuatan oksigen.
- Mereka adalah senyawa yang mengandung setidaknya satu anion oksigen dan kation logam.
Risiko
Lithium oksida adalah senyawa stabil yang tidak kompatibel dengan asam yang kuat, air dan karbon dioksida. Sejauh yang kami tahu, sifat kimia, fisik dan toksikologis lithium oksida belum diselidiki dan dilaporkan secara menyeluruh.
Toksisitas senyawa lithium adalah fungsi kelarutannya dalam air. Ion lithium memiliki toksisitas di sistem saraf pusat. Senyawa ini sangat korosif, mengiritasi jika bersentuhan dengan mata dan kulit, saat dihirup atau dicerna.
Dalam hal kontak mata, Anda harus memverifikasi apakah lensa kontak digunakan dan segera menghapusnya. Mereka harus dibilas dengan air mengalir setidaknya selama 15 menit, menjaga kelopak mata tetap terbuka. Air dingin dapat digunakan, dan bukan salep mata.
Jika bahan kimianya bersentuhan dengan pakaian, simpan secepat mungkin, melindungi tangan dan tubuhnya sendiri. Tempatkan korban di bawah shower pengaman.
Jika bahan kimianya menumpuk di kulit korban yang terbuka, seperti tangan, kulit yang terkontaminasi dengan air mengalir dan sabun non -abasif dicuci dengan lembut dan hati -hati. Air dingin dapat digunakan. Jika iritasi tetap ada, cari perhatian medis. Cuci pakaian yang terkontaminasi sebelum menggunakannya lagi.
Dapat melayani Anda: Skala Rankine: Apa itu, konversi, contohDalam kasus inhalasi, korban harus diizinkan untuk berdiri di daerah berventilasi baik. Jika inhalasinya serius, korban harus dievakuasi ke area yang aman sesegera mungkin.
Kendurkan pakaian ketat, seperti leher kemeja, ikat pinggang atau dasi. Jika korban sulit bernafas, oksigen harus diberikan. Jika korban tidak bernapas, resusitasi mulut dibuat.
Selalu mempertimbangkan bahwa itu bisa berbahaya bagi orang yang memberikan bantuan memberikan resusitasi mulut ke mulut ketika bahan inhalasi beracun, menular atau korosif. Dalam semua kasus, perhatian medis segera harus dicari.
Aplikasi
- Lithium oksida digunakan sebagai pendiri dalam enamel keramik, dan menciptakan biru dengan tembaga dan mawar dengan kobalt. Bereaksi dengan air dan uap, membentuk lithium hidroksida dan harus diisolasi darinya.
- Lithium oksida (LI2O), dengan potensi tritio yang tinggi, merupakan kandidat yang menarik untuk bahan budidaya padat dari pabrik energi fusi DT, karena kepadatan atom lithium yang tinggi (dibandingkan dengan lithium atau keramik lithium logam lainnya) dan konduktivitas termal yang relatif tinggi tinggi.
Li2O Ini akan terkena suhu tinggi di bawah iradiasi neutron selama pengoperasian selimut fusi. Dalam keadaan ini, sejumlah besar cacat iradiasi akan diproduksi di LI2Atau, seperti pembengkakan yang diinduksi helium, ekspansi termal yang relatif tinggi, pertumbuhan butir, pembentukan LYH (T) dan presipitasi pada suhu rendah dan transportasi massa LiOH (T) pada suhu tinggi.
Selain itu, LI2Atau akan mengalami ketegangan yang timbul dari perbedaan ekspansi termal antara LI2O dan bahan struktural. Karakteristik Li ini2Atau menyebabkan masalah rekayasa yang menantang baik di manufaktur maupun dalam desain manta.
Dapat melayani Anda: Strontium hydride (SRH2)- Penggunaan baru yang mungkin seperti penggantian untuk kobalt dan lithium oksida, seperti katoda dalam baterai lithium yang digunakan untuk meningkatkan perangkat ponsel elektronik ke laptop, serta mobil dengan baterai.
Referensi
- Elemen Amerika. Lithium oksida. Pulih dari Amerika Americanement.com.
- Lithium oksida. Pulih dari espimetals espimetals.com.
- Lithium oksida (LI2O). FERP pulih.UCSD.Edu ferp.UCSD.Edu.

