Kalium oksida (K2O)
- 2060
- 476
- Ray Thiel
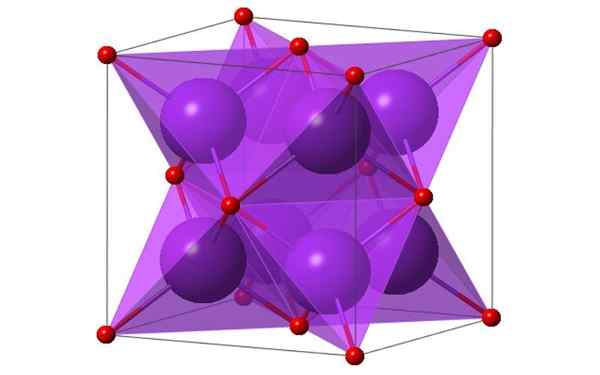
 Desain kubik 4 molekul kalium oksida. Sumber: Ktlabe, Wikimedia Commons
Desain kubik 4 molekul kalium oksida. Sumber: Ktlabe, Wikimedia Commons Apa itu kalium oksida?
Dia Kalium oksida, Juga disebut Dipotasium oksida, itu adalah oksigen ionik dan garam kalium, dengan formula K2SALAH SATU. Itu adalah kalium oksida paling sederhana, sangat reaktif dan jarang ditemukan. Beberapa bahan perdagangan, seperti pupuk dan semen2SALAH SATU.
Kalium oksida diproduksi dari kalium hidroksida (potassa kaustik) dan kalium logam 450 ° C, menghasilkan hidrogen molekuler sesuai dengan persamaan:
2k + 2koh ⇌ 2k2Atau + h2 (450 ° C).
Ini juga diperoleh dengan mengurangi kalium peroksida sesuai dengan reaksi:
2k2SALAH SATU2 → k2Atau + o2 (530 ° C).
Metode lain untuk mendapatkan kalium oksida adalah dengan memanaskan kalium karbonat pada suhu tinggi, seperti yang ditunjukkan oleh reaksi berikut:
K2BERSAMA3 ⇌ k2O + Co₂ (T> 1200 ° C).
Namun, cara utama mendapatkan kalium oksida adalah dengan memanaskan kalium nitrat, mendapatkan nitrogen molekuler seperti yang ditunjukkan oleh reaksi berikut:
2kno3 + 10K → 6K2Atau + n2
Sifat fisik dan kimia
- Mereka adalah kristal tetrahedral, kekuningan, tanpa aroma karakteristik.
- Ini memiliki berat molekul 94,2 g/mol dan kepadatan 2,13 g/ml pada 24 ° C.
- Ini memiliki titik leleh 740 ° C, meskipun mulai terurai pada suhu 300 ° C.
- Itu tahan terhadap panas dan larut dalam etanol dan eter. K2Atau mengkristal dalam struktur antifluorite. Untuk alasan ini, posisi anion dan kation diinvestasikan dalam kaitannya dengan posisi mereka di CAF2, dengan ion kalium terkoordinasi hingga 4 ion oksida dan ion oksida terkoordinasi pada 8 kalium.
- Ini adalah oksida dasar dan bereaksi dengan air dengan keras untuk menghasilkan kalium hidroksida kaustik. Ini lezat dan menyerap air dari atmosfer, memulai reaksi yang kuat ini.
Itu dapat melayani Anda: kalsium nitrat (ca (no3) 2)- Ini teroksidasi secara terbalik menjadi kalium peroksida pada suhu 350 ° C, bereaksi dengan keras dengan asam, seperti asam klorida, untuk membentuk garam kalium sesuai dengan reaksi:
K2O + 2HCL → 2KCL + H₂O.
- Bereaksi dengan nitrogen dioksida untuk membentuk nitrat dan kalium nitrit pada suhu antara 150 dan 200 ° C:
K2O + 2no2 = Kno2 + Kno3
- Bereaksi pada suhu rendah dengan amonia untuk membentuk amidas dan kalium hidroksida sesuai dengan reaksi:
K2O + nh3 (L) → knh2↓ + KOH (-50 ° C).
Risiko
Kalium oksida adalah zat yang tidak stabil. Mudah mengoksidasi kalium, peroksida atau asam kalium (KHO) oksida (KHO) lainnya. Senyawa ini bukan bahan bakar, tetapi bereaksi dengan kuat dan eksotermis dengan air untuk membentuk kalium hidroksida (KOH).
Larutan kalium oksida dalam air adalah basa yang kuat, bereaksi keras dengan asam dan bersifat korosif. Bereaksi keras dengan air yang menghasilkan kalium hidroksida. Menyerang banyak logam di hadapan air.
Zat ini korosif untuk mata, kulit dan saluran udara, serta dengan menelan. Inhalasi aerosol dapat menyebabkan edema paru, yang gejalanya sering dimanifestasikan setelah beberapa jam, dan diperburuk oleh upaya fisik.
Dalam hal kontak mata, Anda harus memverifikasi apakah lensa kontak digunakan dan segera menghapusnya. Mata harus dicuci dengan air mengalir setidaknya selama 15 menit, dengan kelopak mata terbuka. Air dingin dapat digunakan, dan bukan salep mata.
Jika bahan kimianya bersentuhan dengan pakaian, simpan secepat mungkin, melindungi tangan dan tubuhnya sendiri. Tempatkan korban di bawah shower pengaman.
Jika bahan kimianya menumpuk di kulit yang terbuka, seperti tangan, kulit yang terkontaminasi dengan air mengalir dan sabun non -abasif dicuci dengan lembut dan hati -hati. Air dingin dapat digunakan. Jika iritasi tetap ada, cari perhatian medis. Cuci pakaian yang terkontaminasi sebelum menggunakannya lagi.
Itu dapat melayani Anda: rubidio: riwayat, sifat, struktur, mendapatkan, menggunakanJika kontak kulit serius, itu harus dicuci dengan sabun desinfektan dan menutupi kulit yang terkontaminasi dengan krim antibakteri.
Dalam kasus inhalasi, korban harus diizinkan untuk berdiri di daerah berventilasi baik. Jika inhalasinya serius, korban harus dievakuasi ke area yang aman sesegera mungkin.
Kendurkan pakaian ketat, seperti leher kemeja, ikat pinggang atau dasi. Jika korban sulit bernafas, oksigen harus diberikan. Jika korban tidak bernapas, resusitasi mulut dibuat.
Selalu mempertimbangkan bahwa itu bisa berbahaya bagi orang yang memberikan bantuan memberikan resusitasi mulut ke mulut ketika bahan inhalasi beracun, menular atau korosif.
Dalam hal konsumsi, itu tidak memuntahkan muntah. Longgarkan pakaian ketat. Dalam semua kasus, perhatian medis segera harus dicari.
Aplikasi
- Formula kimia k2Atau (atau hanya k) digunakan dalam beberapa konteks industri: Nomor N-P-K untuk pupuk, formula semen dan formula kaca.
Seringkali tidak digunakan secara langsung dalam produk -produk ini, tetapi jumlah kalium dilaporkan dalam hal yang setara2Atau untuk semua jenis senyawa kalium yang digunakan, seperti kalium karbonat.
- Kalium oksida adalah sekitar 83% dari berat kalium, sedangkan kalium klorida hanya 52%. Kalium klorida memberikan kalium lebih sedikit daripada jumlah kalium oksida yang sama.
Oleh karena itu, jika pupuk adalah 30% kalium klorida berdasarkan berat, indeks kalium standarnya, berdasarkan kalium oksida, hanya akan 18,8%. Itu diproduksi dan/atau antara 10 dan 100 ton per tahun zat ini di ruang ekonomi Eropa.
Dapat melayani Anda: Kimia dalam Kehidupan Sehari -hari: +30 Contoh- Zat ini digunakan dalam bahan kimia laboratorium, pupuk, polimer dan produk fitosanitasi. K2O Memiliki penggunaan industri yang menghasilkan pembuatan zat lain (penggunaan produk perantara).
- Kalium oksida digunakan di bidang campuran dan/atau pertanian, kehutanan dan formulasi penangkapan ikan. Ini digunakan untuk pembuatan bahan kimia, produk plastik dan produk mineral (misalnya, plester, semen).
- Ini digunakan di luar ruangan dalam bahan jangka panjang dengan pelepasan kecepatan rendah, misalnya, logam, kayu dan bahan konstruksi plastik.
- Interior, bahan jangka panjang digunakan dengan kecepatan rendah -pelepasan, seperti furnitur, mainan, bahan konstruksi, tirai, alas kaki, produk kulit, produk dan produk kardus, peralatan elektronik.
- Zat ini dapat ditemukan dalam produk dengan bahan berbasis batu, plester, semen, kaca atau keramik (misalnya, pelat, pot / panci, wadah penyimpanan makanan, bahan konstruksi dan insulasi).
- Kalium oksida adalah sumber yang stabil termal, sangat tidak larut, cocok untuk aplikasi kaca, optik dan keramik. Senyawa oksida tidak menghantarkan listrik.
- Ini juga digunakan dalam komponen struktural cahaya dalam kedirgantaraan dan aplikasi elektrokimia seperti baterai bahan bakar di mana konduktivitas ionik menunjukkan.
Referensi
- Elemen Amerika (s.F.). Kalium oksida. Pulih dari Amerika.com.
- Dipassium oksida. Pulih dari echa.Eropa.UE.

