50 Contoh asam dan basa

- 2006
- 190
- Herbert Fritsch
Ada ratusan Contoh asam dan basa yang dapat ditemukan di semua cabang kimia, tetapi secara keseluruhan mereka dipisahkan menjadi dua keluarga besar: anorganik dan organik. Asam anorganik biasanya dikenal sebagai asam mineral, ditandai dengan menjadi sangat kuat dibandingkan dengan organik.
Asam dan basa dipahami sebagai zat yang masing -masing memiliki rasa agung atau saponáceos. Keduanya korosif, meskipun kata 'kaustik' biasanya digunakan untuk basis yang kuat. Singkatnya Ringkasan: Mereka membakar dan menjalankan kulit jika mereka menyentuhnya. Karakteristiknya di media pelarut telah menjadwalkan serangkaian definisi sepanjang sejarah.
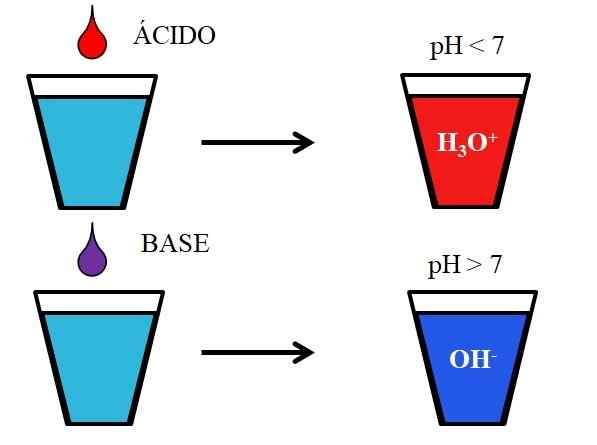 Perilaku asam dan basa saat dilarutkan dalam air. Sumber: Gabriel Bolívar.
Perilaku asam dan basa saat dilarutkan dalam air. Sumber: Gabriel Bolívar. Gambar yang lebih rendah menunjukkan perilaku generik asam dan basa saat ditambahkan atau dilarutkan dalam gelas dengan air. Asam menghasilkan larutan dengan nilai pH di bawah 7 karena ion hidronios, h3SALAH SATU+; Sedangkan basis menghasilkan solusi dengan pH di atas 7 karena ion hidroksil (atau oksidril), oh-.
Jika kita menambahkan asam klorida, HCl (drop merah), ke gelas, akan ada ion H3SALAH SATU+ dan Cl- terhidrasi. Di sisi lain, jika kita mengulangi percobaan dengan natrium hidroksida, NaOH (ungu drop), kita akan memiliki ion OH- dan na+.
[TOC]
Definisi

Karakteristik, semakin dipelajari dan dipahami, dari asam dan basa menetapkan lebih dari satu definisi untuk senyawa kimia ini. Di antara definisi-definisi ini, kita memiliki arrhenius, lowry bronsted, dan akhirnya lewis. Sebelum mengutip contoh -contoh itu perlu untuk mendapatkan ini jelas.
Arrhenius
Asam dan basa, menurut Arrhenius, adalah yang terlarut dalam air menghasilkan ion H3SALAH SATU+ Atau oh-, masing -masing. Artinya, gambar sudah mewakili definisi ini. Namun, dengan sendirinya membenci beberapa asam atau basa yang terlalu lemah untuk menghasilkan ion seperti itu. Di sinilah definisi Bronsted-Lowry masuk.
Dapat melayani Anda: asam: karakteristik dan contohBronsted-Lowry
Asam lowry bronsted adalah yang dapat menyumbangkan ion h+, Dan pangkalannya adalah yang menerima h ini+. Jika asam menyumbang dengan sangat mudah+, Itu berarti itu adalah asam yang kuat. Hal yang sama berlaku untuk pangkalan, tetapi menerima h+.
Dengan demikian, kami memiliki asam dan basa yang kuat atau lemah, dan kekuatannya diukur dalam pelarut yang berbeda; Terutama di dalam air, di mana unit pH yang diketahui didirikan (dari 0 hingga 14).
Oleh karena itu, asam yang kuat akan sepenuhnya menyumbangkan H+ ke air dalam reaksi tipe:
Ha + h2O => a- + H3SALAH SATU+
Kemana- Itu adalah dasar terkonjugasi dari HA. Oleh karena itu, datanglah h3SALAH SATU+ Hadir dalam gelas dengan larutan asam.
Sementara itu, basis B yang lemah tidak terlindungi air untuk mendapatkan masing -masing h+:
B + H2Atau hb + oh-
Di mana Hb adalah asam terkonjugasi b. Ini adalah kasus amonia, NH3:
NH3 + H2Atau nh4+ + Oh-
Basis yang sangat kuat dapat secara langsung menyumbangkan ion OH- Tidak perlu bereaksi dengan air; Seperti naoh.
Lewis
Akhirnya, asam Lewis adalah yang memenangkan atau menerima elektron, dan basa Lewis adalah yang menyumbang atau kehilangan elektron.
Misalnya, pangkalan NH Bronsted-Lowry3 Ini juga merupakan basis Lewis, karena atom nitrogen menerima h+ Dengan menyumbangkan ini sepasang elektron gratis mereka (h3N: h+). Itulah sebabnya ketiga definisi tidak saling tidak setuju, tetapi mereka menjalin dan membantu mempelajari keasaman dan kebasaan dalam spektrum senyawa kimia yang lebih luas.
Dapat melayani Anda: Nikel: Sejarah, Properti, Struktur, Penggunaan, RisikoContoh asam
Setelah mengklarifikasi definisi, serangkaian asam akan disebutkan di bawah ini dengan rumus dan nama masing -masing:
-HF: asam fluorhidric
-HBR: Asam Bromydric
-Hai: Asam Yodhydric
-H2S: asam sulfhidrisi
-H2SE: asam seleenhydric
-H2TE: Asam telurhidri
Ini adalah asam biner, juga disebut hidraceids, yang termasuk asam klorida yang disebutkan di atas, HCl.
-Hno3: asam sendawa
-Hno2: Asam nitrat
-Hno: asam hiponitro
-H2BERSAMA3: Asam karbonat
-H2BERSAMA2: Asam carbonoso, yang sebenarnya lebih dikenal dengan nama asam format, hcooh, asam organik paling sederhana dari semuanya
-H3PO4: Asam fosfat
-H3PO3 atau h2[HPO3]: asam fosfor, dengan ikatan h-p
-H3PO2 atau h [h2PO2]: asam hipofosfer, dengan dua ikatan H-P
-H2Sw4: asam sulfat
-H2Sw3: Asam belerang
-H2S2SALAH SATU7: Asam disulfuri
-Hio4: asam periódic
-Hio3: Asam yodium
-Hio2: asam yodosa
-HIO: asam hipoyodoso
-H2Cro4: Asam kromik
-Hmno4: Asam Manganik
-Ch3COOH: Asam asetat (cuka)
-Ch3Sw3H: asam metanosulfonat
Semua asam ini, kecuali untuk format dan dua yang terakhir, dikenal sebagai oxácidos atau asam terner.
Yang lain:
-Alcl3: aluminium klorida
-FECL3: besi klorida
-Bf3: Boro Trifluoruro
-Kation logam dibubarkan dalam air
-Karbokation
-H (chbsebelasClsebelas): Super Acid Carborano
- Fso3H: asam fluorosulfonat
- HSBF6: Asam fluoroanticonic
- Fso3H · SBF5: Asam ajaib
Empat contoh terakhir membentuk asam super yang menakutkan; senyawa yang mampu menghancurkan hampir semua bahan dengan nyaris tidak menyentuhnya. Alcl3 Ini adalah contoh asam Lewis, karena pusat logam aluminium mampu menerima elektron karena defisiensi elektroniknya (tidak menyelesaikan valencia octet -nya).
Dapat melayani Anda: Merkurius Hydroxide: Struktur, Properti, Penggunaan, RisikoContoh pangkalan
Di antara basis anorganik kami memiliki logam hidroksida, seperti natrium hidroksida, dan beberapa hidnurn molekul, seperti amonia yang sudah dikutip. Berikut adalah contoh pangkalan lainnya:
-KOH: Kalium hidroksida
-Lioh: lithium hidroksida
-RBOH: Rubidio Hydroxide
-CSOH: Cesium hidroksida
-Froh: Francio Hydroxide
-Jadilah (oh)2: Beryl Hydroxide
-Mg (oh)2: magnesium hidroksida
-CA (OH)2: kalsium hidroksida
-Sr (oh)2: Strontium hidroksida
-Ba (oh)2: barium hidroksida
-RA (OH)2: Radio hidroksida
-Iman (oh)2: hidroksida besi
-Iman (oh)3: ferric hidroksida
-Al (oh)3: aluminium hidroksida
-PB (OH)4: Hidroksida plúmbic
-Zn (oh)2: seng hidroksida
-CD (OH)2: cadmium hidroksida
-Cu (oh)2: Hydroxide Cupric
-Ti (oh)4: Titanic Hydroxide
-Ph3: fosfin
-Abu3: Arsina
-Nanh2: natrium amiduro
- C5H5N: Pyridine
-(Ch3) N: trimethylamine
- C6H5NH2: Fenilamin atau anilin
-Nah: natrium hidrida
-KH: Kalium hidrida
-Carbanions
-Li3N: Lithium nitride
-Alkohol
-[(Ch3)2Ch]2NLI: Diisopropilamide lithium
-Anion Dietinilbenzene: C6H4C42- (Basis terkuat yang diketahui sejauh ini)
Referensi
- Whitten, Davis, Peck & Stanley. (2008). Kimia. (Edisi ke -8.). Pembelajaran Cengage.
- Shiver & Atkins. (2008). Kimia anorganik. (Edisi keempat). MC Graw Hill.
- Naomi Henhan. (10 Oktober 2018). Cara mengajarkan asam, basa, dan garam. Pulih dari: edu.RSC.org
- Helmestine, Anne Marie, PH.D. (31 Agustus 2019). Rumus asam dan basa umum. Pulih dari: thinkco.com
- David Wood. (2019). Bandingkan Asam & Basa Umum. Belajar. Pulih dari: belajar.com
- Ross Pomeroy. (23 Agustus 2013). Asam terkuat di dunia: seperti api dan es. Pulih dari: realclearscience.com
- Wikipedia. (2019). Diethynylbenzene Dianion. Diperoleh dari: di.Wikipedia.org
- « Simbol dan formula diameter, cara mengeluarkannya, keliling
- Ekofisiologi apa studi dan aplikasi pada hewan dan sayuran »

