Sejarah Antimoni, Struktur, Properti, Penggunaan dan Risiko

- 2603
- 425
- Leland Robel
Dia antimon Itu adalah metaloid perak berkilau, dan dengan rona biru tertentu. Padatannya juga ditandai dengan menjadi sangat rapuh dan tekstur skuamosa. Itu milik kelompok 15 dari tabel periodik, dipimpin oleh nitrogen. Setelah bismut (dan moskowium), itu adalah elemen terberat dari kelompok.
Itu diwakili oleh simbol kimia SB. Di alam itu terutama ditemukan dalam mineral Stabit dan Ullmannite, yang formulas kimianya adalah SB2S3 dan NISB, masing -masing. Kecenderungannya yang tinggi untuk membentuk sulfida, bukan oksida adalah karena itu lunak secara kimiawi.
 Antimon kristal. Sumber: Best Sci-Fatcs [CC BY-SA 4.0 (https: // createveCommons.Org/lisensi/by-sa/4.0)]
Antimon kristal. Sumber: Best Sci-Fatcs [CC BY-SA 4.0 (https: // createveCommons.Org/lisensi/by-sa/4.0)] Di sisi lain, antimonnya juga lembut secara fisik, menghadirkan kekerasan 3 pada skala Mohs. Itu stabil pada suhu kamar dan tidak bereaksi dengan oksigen udara. Tetapi ketika dipanaskan di hadapan oksigen, ia membentuk antimon trioksida, SB2SALAH SATU3.
Ini juga tahan terhadap aksi asam lemah; Tapi panas diserang oleh asam nitrat dan hidroklorat.
Antimon memiliki banyak aplikasi, di antaranya digunakan dalam paduan dengan timah dan timah, dalam pembuatan baterai untuk kendaraan, bahan gesekan rendah, dll.
Metalloid ini memiliki langka yang dimiliki untuk meningkatkan volume saat dipadatkan, memungkinkan paduannya untuk sepenuhnya menempati ruang yang digunakan untuk membentuk instrumen yang diinginkan untuk memproduksi.
[TOC]
Sejarah Penemuan Anda
Bc
Ada bukti bahwa dari 3100 hingga.C, antimon sulfida digunakan sebagai kosmetik di Mesir. Di Mesopotamia, Irak saat ini, sisa -sisa vas dan artefak lain ditemukan yang diduga tanggal antara 3000 dan 2200 tahun.C, di mana ia digunakan dalam elaborasi antimonnya.
Pengenalan istilah ini
Roman Erúdito Plinio El Viejo (23-79 D.c) menggambarkan penggunaan antimon, yang ia sebut Estibio, dalam elaborasi tujuh obat dalam perjanjian sejarah alaminya. Alkemis Abu Mussa Jahir Ibn Hayyan (721-815) dikaitkan dengan pengenalan istilah antimon untuk menunjuk elemen.
Dia menggunakan etimologi berikut: 'anti' sebagai sinonim untuk penolakan, dan 'mono' untuk saja. Kemudian dia ingin menekankan bahwa antimon itu tidak sendirian di alam. Sudah diketahui bahwa itu adalah bagian dari mineral belerang, yang seperti elemen lainnya.
Memperoleh
Pedanius diascorides naturis Yunani diyakini mendapatkan antimon murni, dengan memanaskan antimon sulfida dalam aliran udara. Vannocio Biringucio Metalurgi Italia, dalam Kitab Piroteknik (1540), membuat deskripsi metode untuk mengisolasi antimonis.
Ahli kimia Jerman Andreas Libavius (1615), melalui penggunaan campuran besi, antimon sulfida, garam dan kalium tartrato, mencapai produksi antimon kristal.
Laporan terperinci pertama tentang antimon dibuat pada 1707 oleh ahli kimia Prancis Nicolas Lemery (1645-1715), dalam bukunya yang diobati dengan antimonis.
Dapat melayani Anda: tembaga klorida (i) (cucl): struktur, sifat, penggunaanStruktur antimon
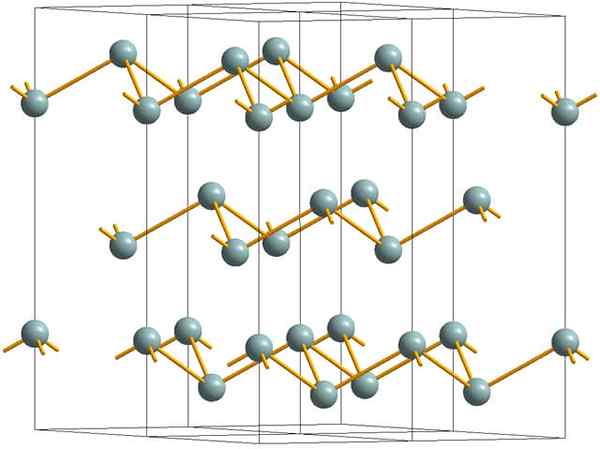 Lapisan keriput yang membentuk struktur kristal antimon logam atau perak. Sumber: MaterialScientist [CC BY-SA 3.0 (https: // createveCommons.Org/lisensi/by-sa/3.0)]
Lapisan keriput yang membentuk struktur kristal antimon logam atau perak. Sumber: MaterialScientist [CC BY-SA 3.0 (https: // createveCommons.Org/lisensi/by-sa/3.0)] Gambar atas menunjukkan struktur lapisan keriput yang diadopsi oleh atom arsenik. Namun, antimon keabu -abuan, lebih dikenal sebagai antimon logam, juga mengadopsi struktur ini. Dikatakan bahwa itu "keriput" karena ada atom SB yang naik dan turun dari pesawat yang terdiri dari lapisan.
Lapisan -lapisan ini, meskipun mereka bertanggung jawab atas foton yang berinteraksi dengannya untuk menyinari perak, menjadikan antimon sebagai logam, kebenarannya adalah bahwa kekuatan yang menyatukan mereka lemah; Dari sini ke fragmen logam SB yang jelas dapat dengan mudah ditampilkan dan rapuh atau sepatu kets.
Selain itu, atom SB dalam lapisan keriput tidak cukup untuk mengelompokkan orbital atom mereka dan dengan demikian membuat pita yang memungkinkan konduksi listrik.
Melihat bola keabu-abuan secara individual, Anda dapat melihat bahwa ia memiliki tiga tautan SB-SB. Dari bidang yang lebih tinggi, SB dapat dilihat di tengah segitiga, dengan tiga SB terletak di simpulnya. Namun, segitiga tidak datar dan memiliki dua tingkat atau lantai.
Reproduksi lateral segitiga seperti itu dan tautannya membentuk lapisan keriput, yang disejajarkan untuk membentuk kristal rhomboébic.
Alotropi
Struktur yang baru dijelaskan sesuai dengan antimon keabu -abuan, yang paling stabil dari empat alotropnya. Tiga alotrop lainnya (hitam, kuning, dan eksplosif) adalah metastabil; yaitu, mereka mungkin ada dalam kondisi yang sangat ketat.
Tidak ada terlalu banyak informasi tentang strukturnya. Namun, diketahui bahwa antimon hitam itu amorf, sehingga strukturnya berantakan dan rumit.
Antimon kuning stabil di bawah -90ºC, berperilaku sebagai elemen non -metalik, dan dapat diduga yang terdiri dari aglomerat SB kecil4 (mirip dengan fosfor); Saat dipanaskan itu berubah menjadi alotrop hitam.
Dan sehubungan dengan antimon peledak, itu terdiri dari tangki agar -agar yang terbentuk pada katoda selama elektrolisis larutan berair halida antimonis.
Untuk sedikit pun rubb yang kuat.
Properti
Berat atom
121.76 g/mol.
Nomor atom
51.
Konfigurasi elektronik
[Kr] 4d105S25 p3.
Keadaan oksidasi
-3, -2, -1, +1, +2, +3, +4, +5.
Deskripsi Fisik
Perak berkilau, rapuh, permukaan skuamosa, dengan rona biru. Itu juga bisa muncul sebagai debu hitam.
Titik lebur
630.63 ºC.
Titik didih
1.635 ºC.
Kepadatan
-6.697 g/cm3 pada suhu kamar.
-6.53 g/cm3 Dalam keadaan cair, suhu sama dengan atau lebih besar dengan titik leleh.
Panas fusi
19.79 kJ/mol.
Panas penguapan
193.43 kJ/mol.
Dapat melayani Anda: tembaga sulfida: struktur, sifat, penggunaanKapasitas kalori molar
25.23 j/mol.K
Elektronegativitas
2.05 (Skala Pauling).
Radio atom
140 PM.
Kekerasan
Ini adalah elemen lembut, dengan kekerasan 3 pada skala Mohs dan dapat digaruk oleh kaca.
Stabilitas
Itu stabil pada suhu kamar, tidak mengalami oksidasi. Itu juga tahan terhadap serangan asam.
Isotop
Ini memiliki dua isotop yang stabil: 121SB dan 123SB. Selain itu, ada 35 isotop radioaktif. Isotop radioaktif 125SB adalah orang dengan setengah -kehidupan terbesar: 2,75 tahun. Secara umum, isotop radioaktif memancarkan radiasi β+ dan β-.
Konduktivitas listrik dan termal
Antimon adalah konduktor panas dan listrik yang buruk.
Reaktivitas kimia
Tidak dapat menggantikan hidrogen dari asam encer. Bentuk kompleks ionik dengan asam organik dan anorganik. Antimon logam tidak bereaksi dengan udara, tetapi dengan cepat diubah menjadi oksida menjadi udara basah.
Halogen dan sulfida dengan mudah mengoksidasi antimon, jika proses terjadi pada suhu tinggi.
Aplikasi
Paduan
Antimony ini digunakan dalam paduan dengan timbal untuk elaborasi pelat untuk baterai mobil, meningkatkan resistensi pelat, serta karakteristik beban.
Paduan timbal dan timah telah digunakan untuk meningkatkan karakteristik lasan, serta peluru pelacak dan kartrid. Ini juga digunakan dalam paduan untuk lapisan kabel listrik.
Antimon ini digunakan dalam paduan antifriksi, dalam persiapan paduan kulit dan pengerasan dengan kandungan timah rendah dalam pembuatan organ dan alat musik lainnya.
Ini menyajikan karakteristik, dibagi dengan air, dari peningkatan volume saat kental; Jadi antimon yang ada dalam paduan dengan timah dan timah, mengisi semua ruang cetakan, meningkatkan definisi struktur yang dibuat dengan paduan ini.
Retardant Api
Antimony trioksida digunakan untuk elaborasi senyawa yang diyakinkan, selalu dalam kombinasi dengan penghambat api yang terhalogenasi, bromuro dan klorida.
Retarder api dapat bereaksi dengan oksigen dan atom radikal oh, yang menghambat api. Igniphed ini digunakan dalam pakaian untuk anak -anak, mainan, pesawat dan kursi mobil.
Mereka juga ditambahkan dalam resin poliester, dan dalam kompos serat kaca untuk barang -barang bekas seperti penutup mesin pesawat ringan.
Senyawa antimon yang digunakan sebagai retarder kebakaran meliputi: antimon oksychloride, SBOCL; Antimony Pentoxide, SBO5; Antimony Trichloride, SBCL3; dan antimon trioksida, sbo3.
Bidang elektronik
Ini digunakan dalam pembuatan semikonduktor, dioda, detektor inframerah tengah, dan dalam elaborasi transitor. Antimon kemurnian tinggi, digunakan dalam teknologi semikonduktor, diperoleh dengan pengurangan senyawa antimon dengan hidrogen.
Dapat melayani Anda: faktor yang mempengaruhi kelarutanKedokteran dan dokter hewan
Senyawa antimon telah digunakan dalam pengobatan sejak zaman kuno seperti eméticas dan antiprotozoa. Kalium kalium tartrato (tartar estetika) digunakan sebagai antisquisosomal untuk waktu yang lama; juga digunakan sebagai ekspekoran, diaforetik dan emético.
Garam antimon juga telah digunakan dalam pengkondisian kulit hewan ruminansia; seperti aniomalin, dan lithium dan antimonis.
Antimon Meglumine adalah obat yang digunakan dalam pengobatan leishmaniasis dalam lampu sorot eksternal hewan peliharaan. Meskipun, manfaat terapeutik langka.
Pigmen dan lukisan
Senyawa antimon digunakan dalam elaborasi cat dan opacifier dalam enamel. Mereka juga digunakan dalam Bermellón, pigmen kuning dan oranye, yang merupakan produk dari oksidasi lambat antimon sulfida.
Beberapa garam organiknya (Tartratos) digunakan dalam industri tekstil untuk membantu dalam tautan pewarna tertentu.
Antimony sulfida digunakan di Mesir kuno sebagai kosmetik dalam gelap mata.
Penggunaan lainnya
Beberapa garam antimon digunakan sebagai agen pelapis untuk menghilangkan gelembung mikroskopis yang dibentuk di layar televisi. Ion antimon berinteraksi dengan oksigen, menghilangkan kecenderungan mereka untuk membentuk gelembung.
Antimony sulfida (III) digunakan di kepala beberapa pertandingan keamanan. Antimon sulfida juga digunakan dalam stabilisasi koefisien gesekan bahan yang digunakan dalam bantalan rem mobil.
Isotop 124SB, bersama dengan berilium, digunakan sebagai sumber neutron, dengan rata -rata energi 24 keV. Selain itu, antimon digunakan sebagai katalis dalam produksi plastik.
Risiko
Ini adalah elemen yang rapuh, sehingga bubuk polutan lingkungan dapat terjadi selama manipulasi. Pada pekerja yang terpapar debu antimon, dermatitis, renitis, peradangan saluran pernapasan tinggi dan konjungtivitis telah diamati.
Pneumoconiosis telah dijelaskan, kadang -kadang dikombinasikan dengan perubahan paru obstruktif, setelah pameran yang berkepanjangan.
Antimony trioksida dapat menyebabkan kerusakan pada fungsi jantung yang bisa fana.
Pada orang yang terpapar elemen ini, keberadaan infeksi kulit pustular telah diamati, bersifat sementara.
Asupan dosis rendah terus menerus dari logam ini dapat menyebabkan muntah diare dan borok lambung. Juga, konsentrasi maksimum yang dapat ditoleransi di udara adalah 0,5 mg/m3.
Referensi
- Shiver & Atkins. (2008). Kimia anorganik. (Edisi keempat). MC Graw Hill.
- Manny. (11 Maret 2009). Antimon kuning dan antimon peledak. Diperoleh dari: Antimonyproperties.Blogspot.com
- Prof. Ernst Cohen dan J. C. Van den Bosch. (1914). Alotropi antimon. PROSEDING ROYAL ACAD. Amsterdam. Vol. Xvii.
- Wikipedia. (2019). Antimon. Diperoleh dari: di.Wikipedia.org
- Advameg, Inc. (2019). Antimon. Pulih dari: chemistry explaed.com
- MC'oneal Sabre. (15 September 2018). Kimia: Properti dan Penerapan Antimon SB. Pulih dari: medium.com
- « Sejarah Biogeografi, Contoh Penelitian dan Penelitian Apa
- Penyebab Polusi Auditori, Konsekuensi, Solusi »

